- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азот( урок-сказка)
Содержание
- 2. При помощи периодической системы Д.И. Менделеева дайте характеристику строению атома азота.Объясните многообразие кислородных соединений азота.
- 3. Получение азота1. Промышленный способ. Перегонка
- 4. Свойства азотаМолекула азота (:NºN:)Очень устойчива (три ковалентные
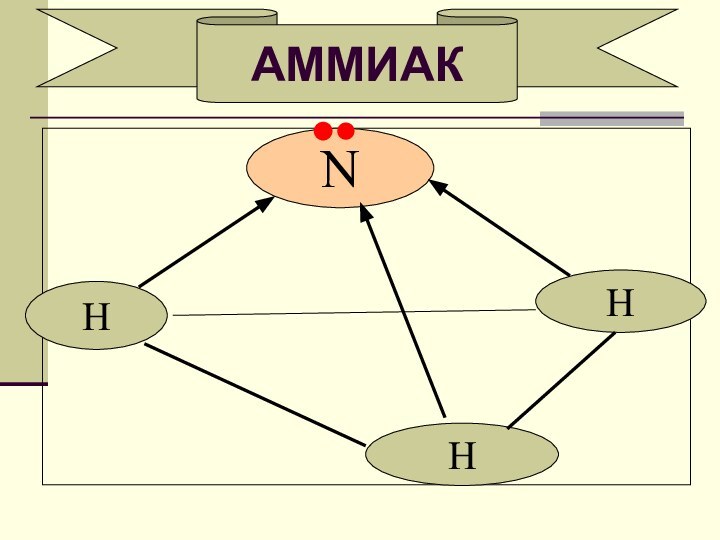
- 5. NNАММИАКHHH
- 6. Благодаря водородным связям, аммиак имеет сравнительно высокие
- 7. ХИМИЧЕСКИЕ СВОЙСТВАСпособ образования катиона аммонияNH3 + Н2O NH4OH NH4+ + OH-
- 8. Что может служить сырьем для получения аммиака?
- 9. 1. Промышленный способN2 + 3H2
- 10. КАКИМ СПОСОБОМ МОЖНО СОБРАТЬ АММИАК?
- 11. 1. Разложение при нагревании2N-3H3 t°
- 12. Кислородсодержащие соединения азотаN2OОКСИД АЗОТА (I)ЗАКИСЬ АЗОТА, "ВЕСЕЛЯЩИЙ
- 13. Какой оксид при комнатной температуре легко окисляется?
- 14. АЗОТНАЯ КИСЛОТА (ее специфические свойства)АЗОТНАЯ КИСЛОТА (ее
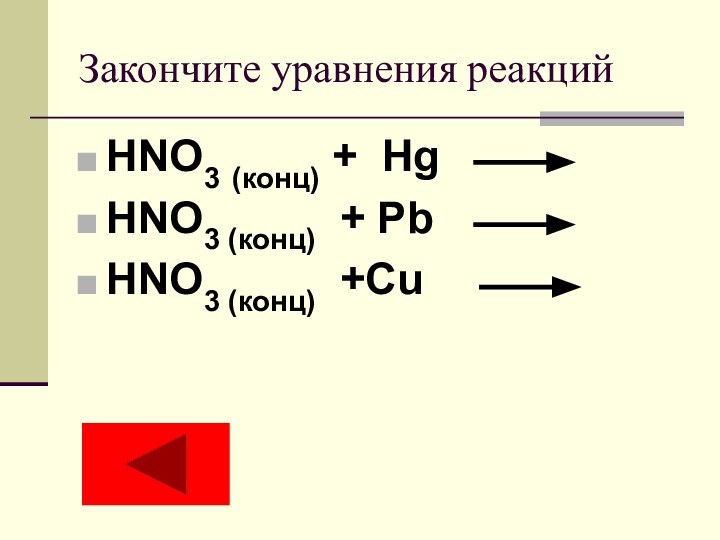
- 15. Закончите уравнения реакцийHNO3 (конц) + Hg HNO3 (конц) + Pb HNO3 (конц) +Cu
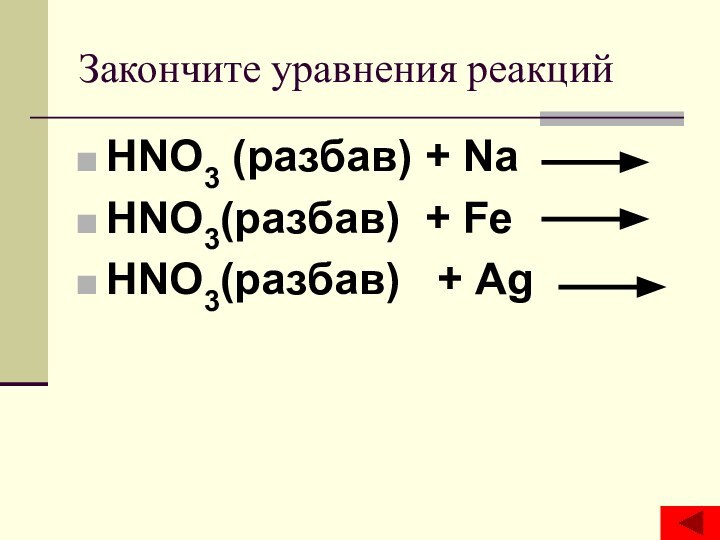
- 16. Закончите уравнения реакцийHNO3 (разбав) + Na HNO3(разбав) + Fe HNO3(разбав) + Ag
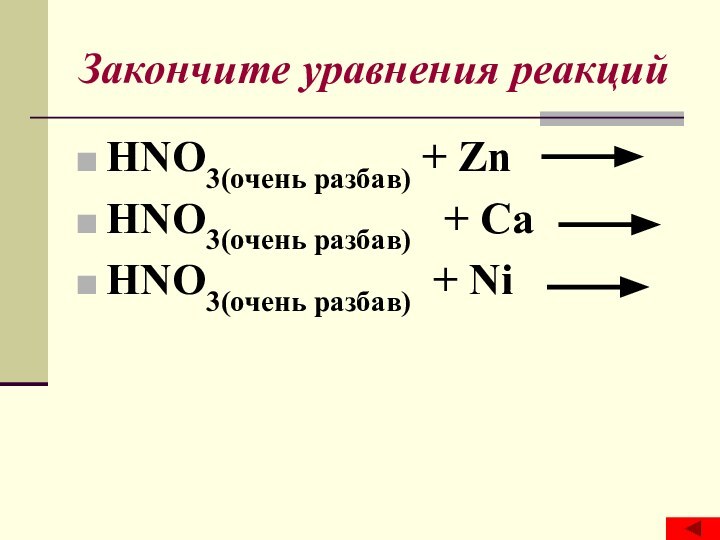
- 17. Закончите уравнения реакций HNO3(очень разбав) + Zn
- 18. 1.Какие металлы не взаимодействуют с холодной концентрированной
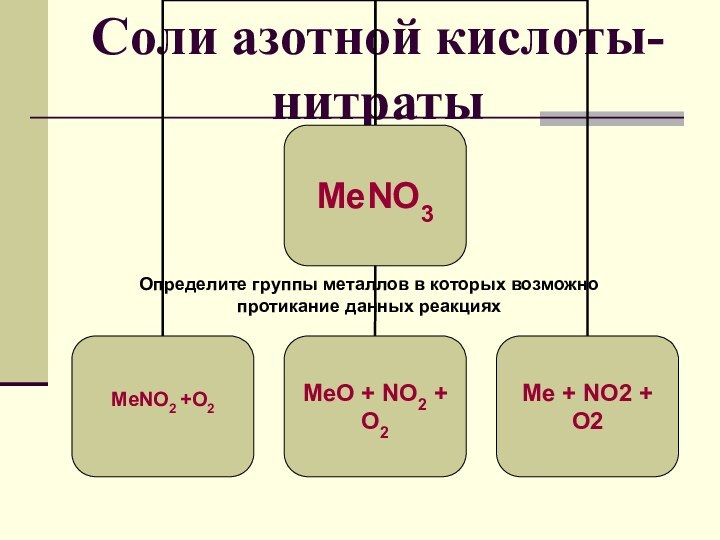
- 19. Соли азотной кислоты- нитратыОпределите группы металлов в которых возможно протикание данных реакциях МеNO2 +O2
- 20. 1 группа Li - Mg2 группа Al - Pb3 группа Cu и правее
- 21. РЕФЛЕКСИЯ При помощи картинки выразите свое отношение к уроку.
- 22. Домашнее заданиеПовторить §24-27, еще раз обратить внимание на специфические свойства азотной кислоты.
- 23. Скачать презентацию
- 24. Похожие презентации
















Слайд 3
Получение азота
1. Промышленный способ. Перегонка жидкого
воздуха.
2. Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –t°
N2 + 2H2O
Слайд 4
Свойства азота
Молекула азота (:NºN:)
Очень устойчива (три ковалентные связи),
поэтому обладает низкой реакционной способностью.
Восстановитель N20
2N+2Высокая температура (электрическая дуга, 3000°С)
N20 + O20 2N+2O
(в природе - во время грозы)
Окислитель N20 2N-3
1. c водородом (500°С, kat, p)
N20 + 3H20 2N-3HЗ
2. с активными металлами (с щелочными и щел.зем. металлами)
6Li + N20 2LiЗN-3
3Mg + N20 –t° MgЗ N2-3
Слайд 6 Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип.
и t°пл., а также высокую теплоту испарения, он легко
сжимается. Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм)В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается. Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм)В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".
ПОЛУЧЕНИЕ
АММИАКА
Слайд 9
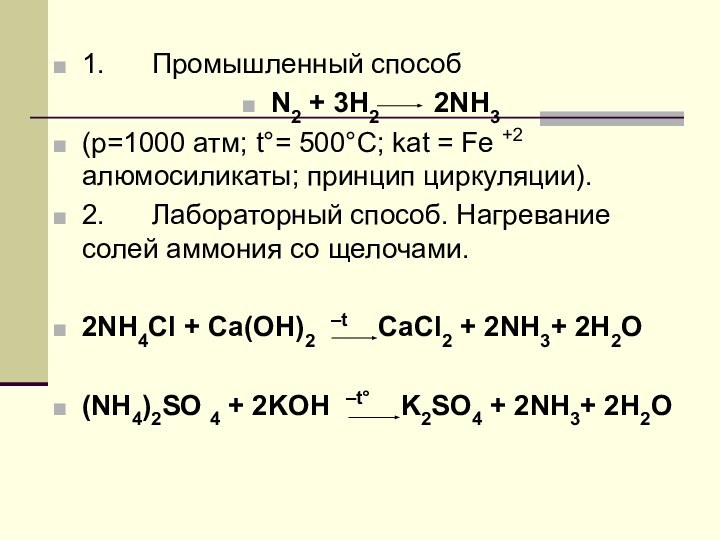
1. Промышленный способ
N2 + 3H2
2NH3
(p=1000 атм; t°= 500°C; kat = Fe
+2 алюмосиликаты; принцип циркуляции).2. Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 –t CaCl2 + 2NH3+ 2Н2O
(NH4)2SO 4 + 2KOH –t° K2SO4 + 2NH3+ 2Н2O
Слайд 11
1. Разложение при нагревании
2N-3H3 t°
N20 + 3H2
2. Горение в кислороде
a)
без катализатора4N-3H3 + 3O2 2N20 + 6Н2O
b) каталитическое окисление ( kat = Pt )
4N-3H3 + 5O2 4N+2O + 6Н2O
3. Восстановление оксидов некоторых металлов
3Cu+2O + 2N-3H3 3Cu + N2 + 3Н2O
Аммиак - восстановитель
(окисляется до N2+1O или N+2O)
Слайд 12
Кислородсодержащие соединения азота
N2O
ОКСИД АЗОТА (I)
ЗАКИСЬ АЗОТА, "ВЕСЕЛЯЩИЙ ГАЗ»
NO
ОКСИД
АЗОТА (II)
ОКИСЬ АЗОТА
N2O3
ОКСИД АЗОТА (III)
АЗОТИСТЫЙ АНГИДРИД
NO2
ОКСИД АЗОТА (IV)
ДВУОКИСЬ АЗОТА,
ДИОКСИД АЗОТАN2O5
ОКСИД АЗОТА (V)
АЗОТНЫЙ АНГИДРИД
Определите степень окисления атома азота в оксидах
Слайд 13
Какой оксид при комнатной температуре легко окисляется? Напишите
уравнение реакции
Какой оксид при взаимодействии с водой одновременно образует
две кислоты? Напишите уравнение реакции
Слайд 14
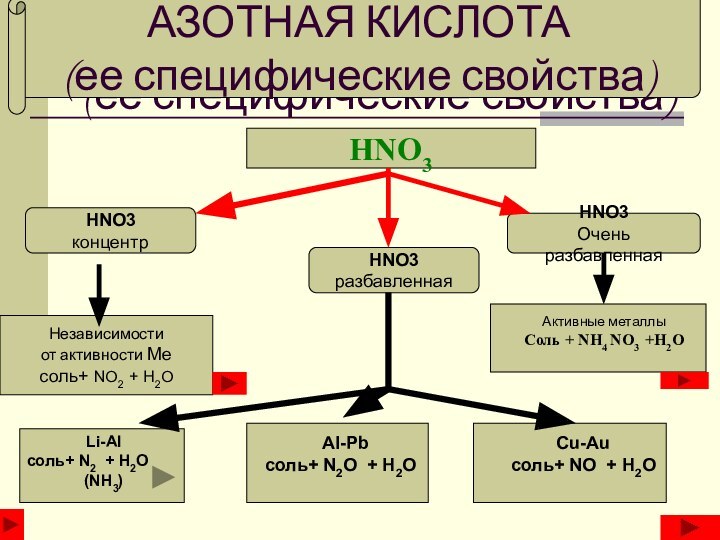
АЗОТНАЯ КИСЛОТА
(ее специфические свойства)
АЗОТНАЯ КИСЛОТА
(ее специфические свойства)
HNO3
HNO3
концентр
HNO3
разбавленная
HNO3
Очень разбавленная
Независимости
от активности Ме
соль+ NO2 + H2O
Li-Al
соль+ N2 + H2O
(NH3)
Al-Pb
соль+
N2O + H2OCu-Au
соль+ NO + H2O
Активные металлы
Соль + NH4 NO3 +H2O