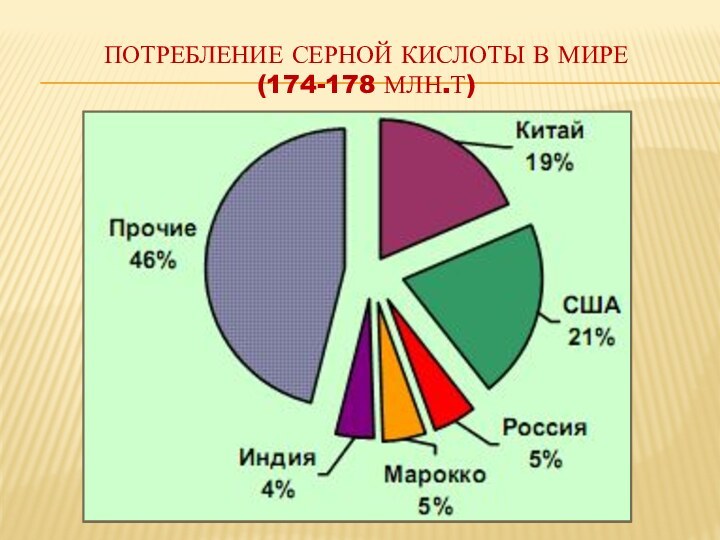
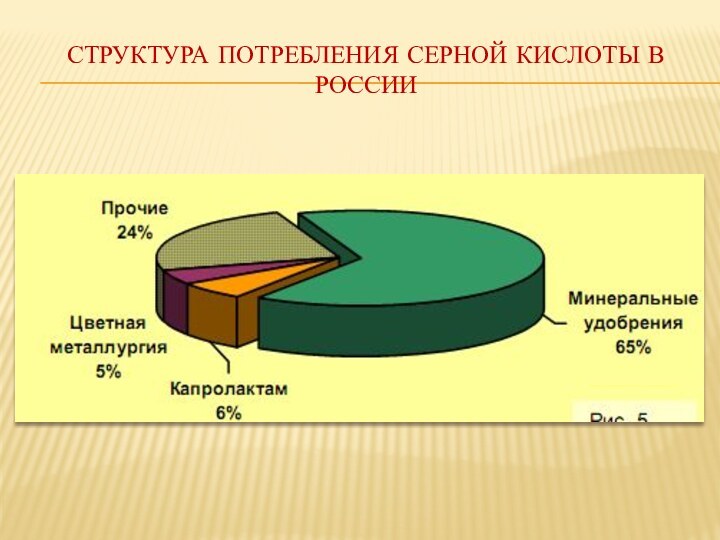
соединение, представляет собой бесцветную маслянистую жидкость без запаха плотностью
1,83 г/см3Пагубно действует на растительные и животные ткани, отнимая от них воду, вследствие чего они обугливаются
С водой смешивается во всех соотношениях, причём при разбавлении соединения водой происходит сильное разогревание, сопровождающееся разбрызгивание жидкости. Разбавляем по правилу: «Химик! Запомни как оду! Лей кислоту в воду!!!»
Одна из самых сильных кислот. В водных растворах практически полностью диссоциирует на ионы:
H2SO4 = 2 Н+ + SO42-
Раствор оксида серы (+6) SO3 в серной кислоте называется олеумом H2SO4●SO3