Слайд 2
Цели и задачи реферата
Фтор довольно распространен в
природе. Процентное содержание его в земной коре приближается к
содержанию таких элементов, как азот, сера, хром, марганец и фосфор. И в тоже время соединения этих элементов широко описаны в любой химической литературе, тогда как о фторе и его соединениях даны лишь небольшие справочные данные.
Задачи моего реферата следующие:
Исследовать историю открытия фтора и его распространение в природе.
Описать физические и химические свойства фтора.
Собрать данные о соединениях фтора.
Изучить применение фтора и его соединений.
Слайд 3
Историческая справка
О существовании элемента, который впоследствии был
назван фтором (от греческого «фторос» - разрушение, гибель), догадывались
многие химики конца XVIII – начала XIX в., но получить его в чистом виде из-за его необычайной активности долго не удавалось.
Одно из самых интересных соединений фтора – плавиковая кислота HF, была получена в 1771 г. знаменитым шведским химиком К.Шееле, который предположил, что в этой кислоте содержится новый химический элемент.
Но прошло больше ста лет, прежде чем химики выделили наконец этот элемент. Произошло это в 1886 г., первооткрывателем свободного фтора стал французский химик А. Муассан.
Слайд 4
Происхождение фтора
Название «фтор», предложенное А.Ампером в 1810г, употребляется
только в русском языке, во многих странах применяют название
«флюор».
Слайд 5
Нахождение в природе
Фтор распространяется в природе
довольно широко. Его содержание в земной коре 6,25 .10-2%
от общей массы.
Свободный фтор в природе фактически не встречается.
Основная масса фтора распределена по различным горным породам.
Из минералов, содержащих фтор наибольшее значение имеют
плавиковый шпат(флюорит) CaF2,
апатит Ca10 (F,CI)2 (PO4 )6 ,
криолит Na3 AlF6.
Слайд 6
Физические свойства фтора
Фтор – ядовитый газ. В обычных
условиях фтор – газ бледно-желтого цвета, с резким характерным
запахом, напоминающим запах хлора и озона, обнаруживаемым даже при следах фтора.
В жидком виде фтор имеет канареечно-жёлтый цвет.
Молекула фтор двухатомна (F2); теплота её диссоциации точно неустановленна и зависимости от метода измерения колеблется от 51 до 73 ккал/моль.
Слайд 7
Химические свойства фтора
Фтор в своих соединениях бывает только
отрицательно одновалентным.
Уже на холоде фтор энергичен: соединяется с бромом,
йодом, серой, фосфором, кремнием, большинством металлов, причем эти реакции часто сопровождаются взрывом.
Самое простое средство тушения пожаров – вода – горит во фторе светло-коричневым пламенем.
С органическими веществами фтор образует фторорганические соединения.
Слайд 8
Отравление
фтором и его соединениями
Острые отравления фтором в
производственных условиях наблюдаются крайне редко, лишь при авариях.
При
высоких концентрациях фтористого водорода в воздухе, проявляются раздражение глаз и слизистой оболочки гортани и бронхов, слёзотечение, слюнотечение, носовые кровотечения.
На кожу плавиковая кислота действует прижигающее, вызывая образование трудно заживающих язв. Фтористые соединения действуют угнетающе на ферменты энолазу, холинэстеразу и другие, а также вызывают нарушение кальциевого и фосфорного обмена.
Лечение при отравлении соединениями фтора – питьё 0,5 – 1% раствора хлористого кальция с смесью жжёной магнезии, промывание желудка такой же смесью; внутривенное введение 10% раствора хлористого кальция (10мл).
Слайд 9
Техника безопасности
Для индивидуальной защиты от фтористых соединений
применяются резиновые перчатки и обувь, спецодежда, противогазы, противопылевые респираторы
и др.
Рабочие, занятые на производстве фтора, плавиковой кислоты, фторорганических соединений, на производстве и применении фтористого бериллия и фторокиси бериллия, подлежат периодическому медицинскому осмотру раз в 6 месяцев, а в некоторых производствах – 1 раз в год.
Дополнительное специальное питание назначается при производстве суперфосфата, криолита, фторпроизводных и фторсодержащих солей. Рекомендуются витамины группы В, аскорбинат кальция, пища, богатая кальцием.
Слайд 10
Применение
Наибольшее применение
получили соединения фториды:
фторид кислорода используют в реактивной технике как
наиболее мощные окислители после озона,
плавиковая кислота – в качестве растворителя и для травления стекла,
фтористый бор применяют в жидком виде как окислитель жидкого реактивного топлива, для фторирования соединений урана в атомной промышленности и т. д.,
уран шестифтористый – для выделения радиоактивного изотопа урана в атомной технике
Слайд 11
Применение
сера шестифтористая – в качестве газа для
изоляции высоковольтных установок,
фтористый натрий – для борьбы с вредителями
сельскохозяйственных растений,
криолит – при производстве алюминия,
плавиковый шпат широко используется в металлургии и при изготовлении эмалей,
элементарный фтор применяют в жидком виде как окислитель реактивного топлива и для обеззараживания питьевой воды,
фреоны применяются как хладагенты в холодильных установках.
Слайд 12
Фтор в организме
Фтор – постоянная составная
часть растительных и животных организмов.
При увеличении или уменьшении
уровня фтора в воде у пресноводных и наземных животных наблюдается заболевания; например, при содержании фтора в воде, больше 0,00005%, может развиться флюороз - заболевание, сопровождающееся пятнистостью эмали и хрупкостью зубов.
При содержании фтора, не достигающем этого уровня, наступает кариес зубов (разрушение эмали и дентина зубов).
Фтор поступает в живой организм, помимо питьевой воды, с пищевыми продуктами, в которых содержится в среднем около
0,02-0,05 мг % фтора.
Слайд 13
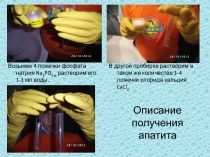
Получение
Получают фтор электролизом
расплава кислого трифторида калия KF· 2HF, так как фтор
обладает чрезвычайно большой реакционной способностью.
При переработке природных фосфатов на искусственные удобрения в качестве побочных продуктов получают фтористые соединения, применяемые в жидком виде как окислитель жидкого реактивного топлива, для фторирования соединений урана в атомной промышленности.