- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азотная кислота и её свойства
Содержание
- 2. Индивидуальная работаОсуществите превращения1 вариант:N2 → NO→NO22 вариант:N2→NH3→(NH4)SO43 вариант:NH3→N2→K3N
- 3. HNO 3
- 4. СодержаниеСтруктурная формулаФизические свойства Химические свойства Получение азотной кислоты
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА Бесцветная жидкость с едким запахом.Гигроскопична,
- 7. ХИМИЧЕСКИЕ СВОЙСТВА- Общие с другими кислотами- - Специфические свойства
- 8. Разбавленная азотная кислота проявляет все свойства кислот:1.
- 9. Азотная кислота проявляет особые свойства: Взаимодействие с металламиВзаимодействие с неметалламиВзаимодействие с органическими соединениями
- 10. Взаимодействие с металламиВ таких реакциях водород, как
- 11. Концентрированная HNOНа Fe, Cr, Al, Au, Pt,
- 12. Разбавленная HNOС тяжелыми металлами – выделяется NO3Ag
- 13. Взаимодействие с неметаллами Азотная кислота взаимодействует
- 14. Взаимодействие с органическими соединениямиС белками – появление ярко-желтого окрашиванияС бензолом – получение взрывчатых веществ
- 15. Производство азотной кислотыПолучение: Лабораторный способ В лаборатории
- 16. Промышленный способ получения азотной кислотыПолучение азотной кислоты окислением аммиака кислородом воздуха
- 17. Получение азотной кислоты в промышленности
- 18. Схема получения азотной кислотыПодготовка аммиачно-воздушной смесиОкисление аммиака
- 19. Химические реакции получения азотной кислоты в промышленностиПодготовка
- 20. Домашнее задание:§19.8 выписать:Записать уравнения реакций распознавания нитратов
- 21. Скачать презентацию
- 22. Похожие презентации
Индивидуальная работаОсуществите превращения1 вариант:N2 → NO→NO22 вариант:N2→NH3→(NH4)SO43 вариант:NH3→N2→K3N



















Слайд 2
Индивидуальная работа
Осуществите превращения
1 вариант:
N2 → NO→NO2
2 вариант:
N2→NH3→(NH4)SO4
3 вариант:
NH3→N2→K3N
Слайд 4
Содержание
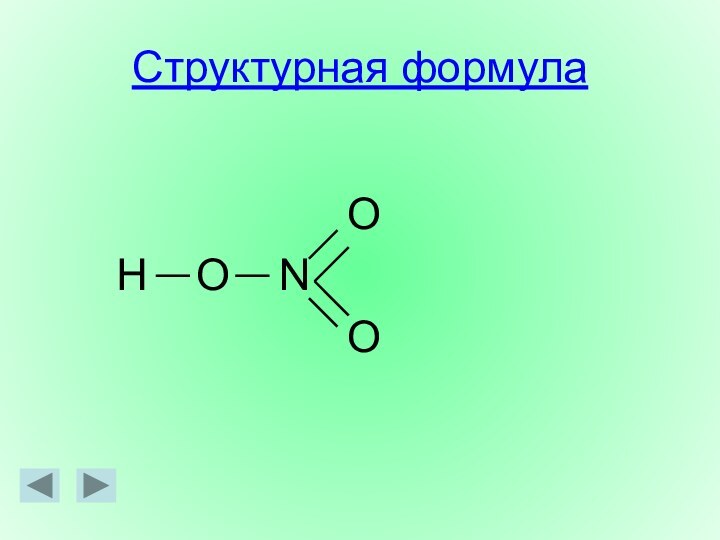
Структурная формула
Физические свойства
Химические свойства
Получение азотной кислоты
Слайд 6
ФИЗИЧЕСКИЕ СВОЙСТВА
Бесцветная жидкость с едким запахом.
Гигроскопична, дымит
на воздухе.
Смешивается с водой в любых соотношениях.
Температура кипения 86°С.
Слайд 8
Разбавленная азотная кислота проявляет все свойства кислот:
1. в
водных растворах диссоциирует
2. взаимодействует с основными оксидами
3. взаимодействует с
основаниями
Слайд 9
Азотная кислота проявляет особые свойства:
Взаимодействие с металлами
Взаимодействие
с неметаллами
Взаимодействие с органическими соединениями
Слайд 10
Взаимодействие с металлами
В таких реакциях водород, как правило,
не выделяется: он окисляется, образуя воду. Кислота, в зависимости
от концентрации и активности металла, может восстанавливаться до соединений:NO2 HNO2 N2O N2 NH3(NH4NO3)
Слайд 11
Концентрированная HNO
На Fe, Cr, Al, Au, Pt, Ir,
Ta не действует
С другими тяжелыми металлами –
выделяется NO2
Ag
+ 2HNO3(конц) = AgNO3 + NO2 + H2O С щелочными и щелочноземельными металлами – выделяется N2O
4Na + 6HNO3(конц) = 4NaNO3 + N2O + 3H2O
3
Слайд 12
Разбавленная HNO
С тяжелыми металлами – выделяется NO
3Ag +
4HNO3(разб) = 3AgNO3 + NO + 2H2O
С щелочноземельными
металлами ,а также с Zn, Fe – выделяется NH34Zn + 10HNO3(разб) = 4Zn(NO3)2 + 2NH3 + 2H2O
3
Слайд 13
Взаимодействие с неметаллами
Азотная кислота взаимодействует со
многими неметаллами, окисляя их до соответствующих кислот:
S +
2HNO3 = H2SO4 + 2NO3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
C + 4HNO3 = CO2 + 2H2O + 4NO2
Слайд 14
Взаимодействие с органическими соединениями
С белками – появление ярко-желтого
окрашивания
С бензолом – получение взрывчатых веществ
Слайд 15
Производство азотной кислоты
Получение:
Лабораторный способ
В лаборатории азотную
кислоту получают
NaNO3 + Н2SO4 = NaНSO4
+ НNO3
Слайд 16
Промышленный способ получения азотной кислоты
Получение азотной кислоты окислением
аммиака кислородом воздуха
Слайд 18
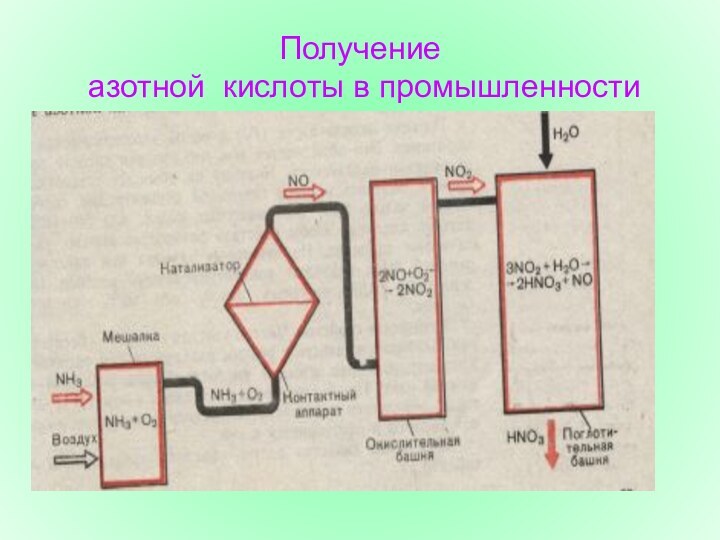
Схема получения азотной кислоты
Подготовка аммиачно-воздушной смеси
Окисление аммиака до
оксида азота (П)
Окисление оксида азота (П) до оксида азота(1У)
Поглощение
оксида азота (1У) водой и получение азотной кислоты
Слайд 19
Химические реакции получения азотной кислоты в промышленности
Подготовка аммиачно-воздушной
смеси
2 Окисление аммиака до оксида азота (П)
3 Окисление оксида
азота (П) до оксида азота(1У)4Поглощение оксида азота (1У) водой и получение азотной кислоты