которых кроме одинарных связей содержится одна двойная связь между
атомами углерода.Общая формула: СnH2n
CnH2n
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть







Общая формула: СnH2n
CnH2n
транс-бутен - 2
СН3
Н
4. Межклассовая изомерия.
СН2
СН
СН3
пропен
циклопропан
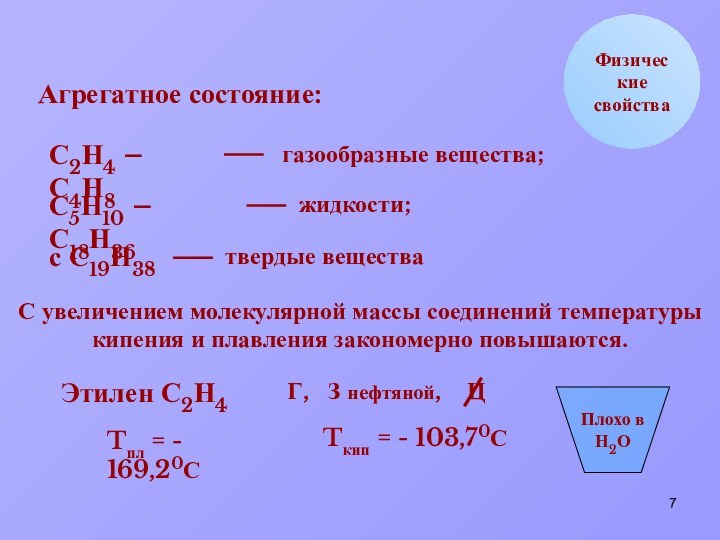
Tпл = - 169,20С
Tкип = - 103,70С
Плохо в
Н2О
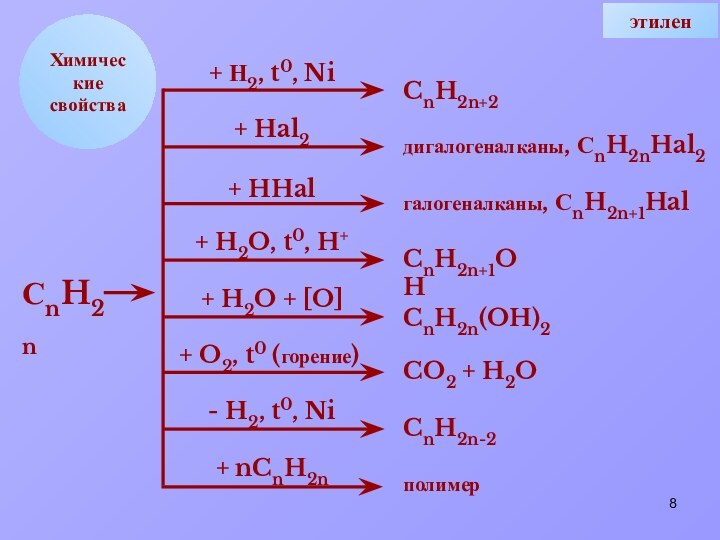
+ nCnH2n
CnH2n+2
дигалогеналканы, СnH2nHal2
галогеналканы, СnH2n+1Hal
CnH2n+1OH
CnH2n(OH)2
CO2 + H2O
CnH2n-2
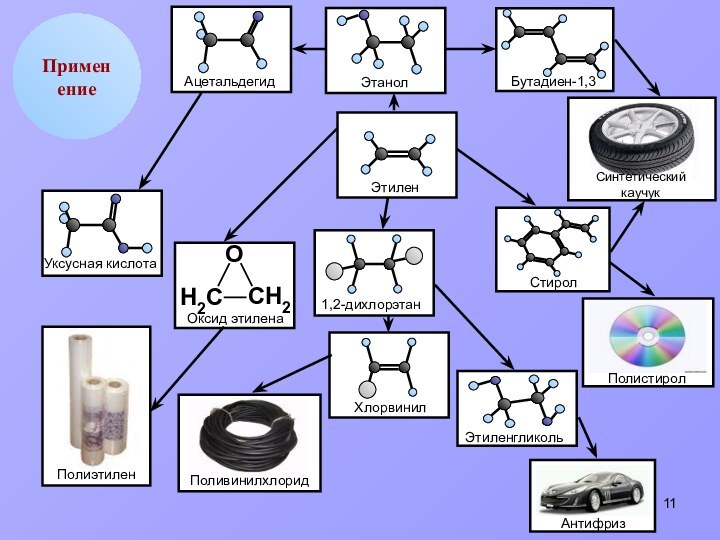
полимер
СnH2n
этилен
+ Н2
СН3
СН3
2. Галогенирование:
СН2
СН2
+ Br2
СН2Вr
СН2Вr
3. Гидрогалогенирование:
СН2
СН2
+ НСl
CН3
СН2Сl
СН2
СН2
+ Н2О
t, Н3РО4
CН3
СН2ОН
5. Мягкое окисление:
СН2
СН2
+ [О] +Н2О
СН2
СН2
ОН
6. Горение:
СН2
СН2
+ 3О2
2СО2
2Н2О
7. Дегидрирование:
СН2
СН2
t, Ni
СН
+ Н2
8. Полимеризация:
nСН2
СН2
cat
( …
СН2
СН2
…)n
главная
СН2
+ Н2О
4. Дегидрогалогенирование (отщепление галогеноводорода):
СН3
СН2
СН3
+ NaОН
спирт, t
СН
СН3
СН
СН
СН3
+NaBr
+Н2О
5. Дегалогенирование:
СН3
СН
СН3
СН
+Zn
Br
Br
СН3
СН
СН
СН3
+ZnBr2