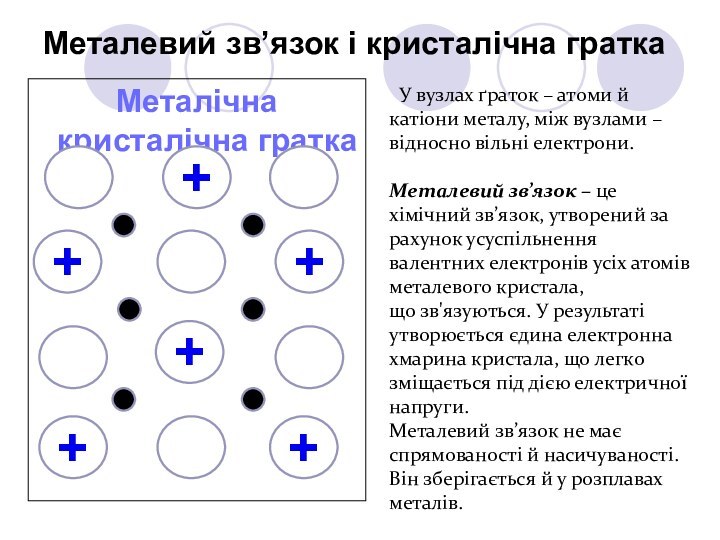
їх атомів
І, ІІ, ІІІ групи, головні підгрупи, побічні підгрупи,
лантаноїди, актиноїдиКоли в П.С. елементів Д. І. Менделєєва провести діагональ від берилію (Be) до астату (At), то справа вгорі від діагоналі будуть знаходиться елементи-неметали (виключаючи елементи побічнихпідгруп), а зліва внизу – елементи-метали. Найбільш типові елементи – метали розміщені на початку періодів(починаючи з 2). Таким чином із 113 ілементів 85 являються металами.