- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Карбоновые кислоты
Содержание
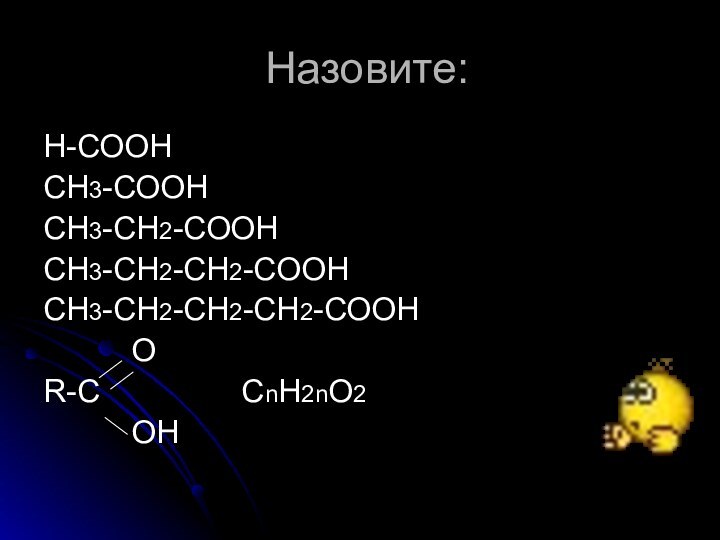
- 2. Назовите:Н-СООНСН3-СООНСН3-СН2-СООНСН3-СН2-СН2-СООНСН3-СН2-СН2-СН2-СООН OR-C
- 3. Выберите изомеры и гомологи.а)СН3-СН-СООН б)
- 4. Классифицируйте:1.
- 5. Химические свойства:Неорганические
- 6. Особые свойства:Реакция этерификации
- 7. Продолжите реакции: CH3COOH+ NaOH ( запишите ионное уравнение)CH3COOH+ СН3ОНCH3COOH+ ZnCH3COOH+ Cu(OH)2CH3COOH + Na2SiO3CH3COOH+ С3Н7ОН
- 8. Почему практически не осуществимы реакции:CH3COOH + CuCH3COOH + K2SO4CH3COOH + SO3CH3COOH
- 9. Карбоновые кислоты: - диссоциируютРеагируют с металлами (до
- 10. Скачать презентацию
- 11. Похожие презентации
Назовите:Н-СООНСН3-СООНСН3-СН2-СООНСН3-СН2-СН2-СООНСН3-СН2-СН2-СН2-СООН OR-C CnH2nO2 OH








Слайд 3
Выберите изомеры и гомологи.
а)СН3-СН-СООН б)
СН3
СН3 СН3- С- СООНСН3
в)СН3-СН2-СН2-СООН г)СН3-СН2-СН-СООН
СН3
д) СН3-СН2-СН2-СОН
е) СН3-СН2-СН2-СН2ОН
Слайд 5
Химические свойства:
Неорганические карбоновые
HCl↔
H+ + Cl-
HCOOH ↔ HCOO- + H+Mg+2HCl=MgCl2+H2 2HCOOH+Mg (HCOO)2Mg+H2
MgO+HCl= HCOOH+MgO
Mg(OH)2+HCl= HCOOH+Mg(OH)2
MgCO3+HCl= HCOOH+MgCO3
HCOONa
CH3COOK
(CH3COO)2Ca
CH3COOH ↔ CH3COO- + H+
Слайд 6
Особые свойства:
Реакция этерификации
t, Н2SO4
СН3-СО-ОН+С2Н5ОН ↔ СН3-СО-ОС2Н5+Н2О
Для непредельных – гидрирование.
Для предельных – хлорирование
P красный
СН3-СООН+ Сl2 ↔ CH2Cl- COOH+ HCl
Слайд 7
Продолжите реакции:
CH3COOH+ NaOH ( запишите ионное уравнение)
CH3COOH+
СН3ОН
CH3COOH+ Zn
CH3COOH+ Cu(OH)2
CH3COOH + Na2SiO3
CH3COOH+ С3Н7ОН
Слайд 9
Карбоновые кислоты:
- диссоциируют
Реагируют с металлами (до водорода)
Реагируют
с основными и амфотерными оксидами
Реагируют с основаниями
Реагируют с солями
более слабых кислотВступают в реакцию этерификации
С предельными галогенирование
С непредельными гидрирование.