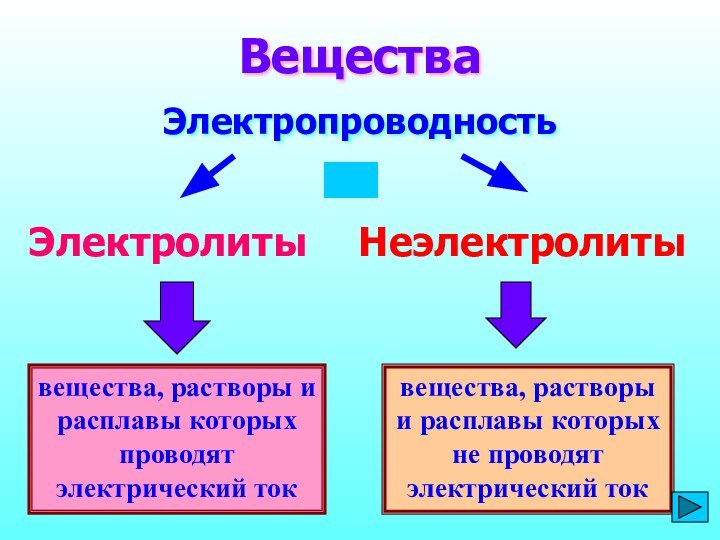
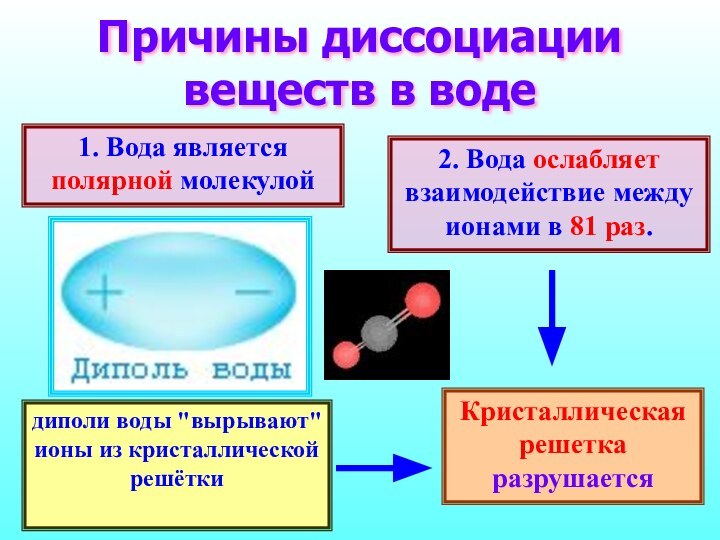
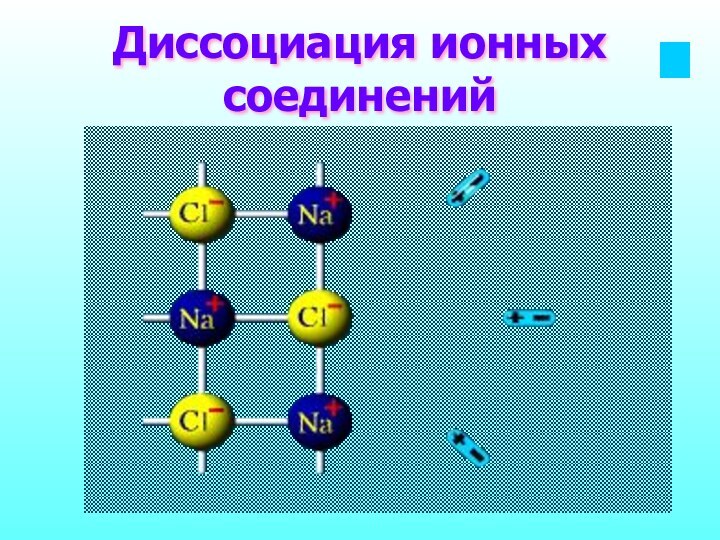
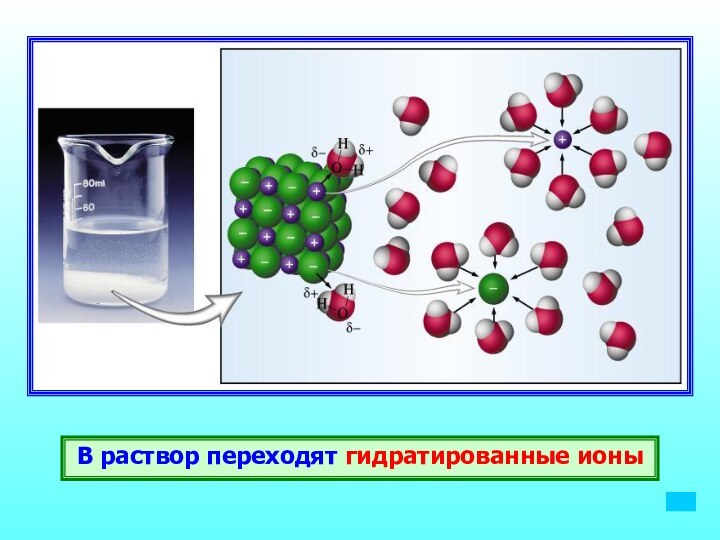
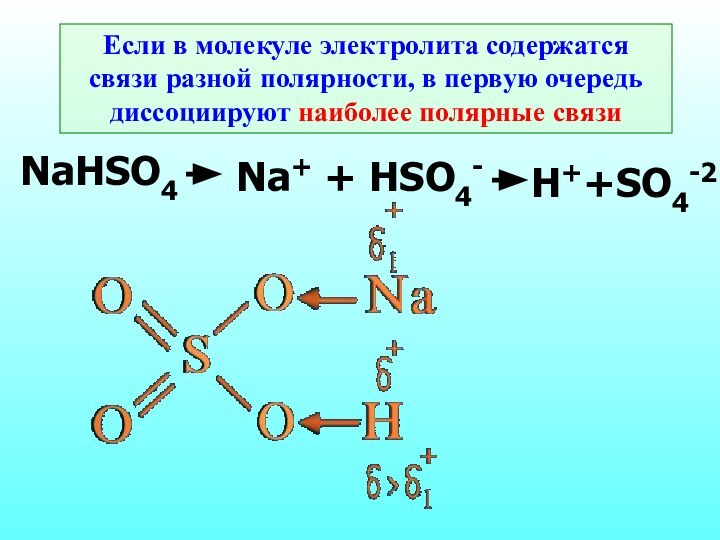
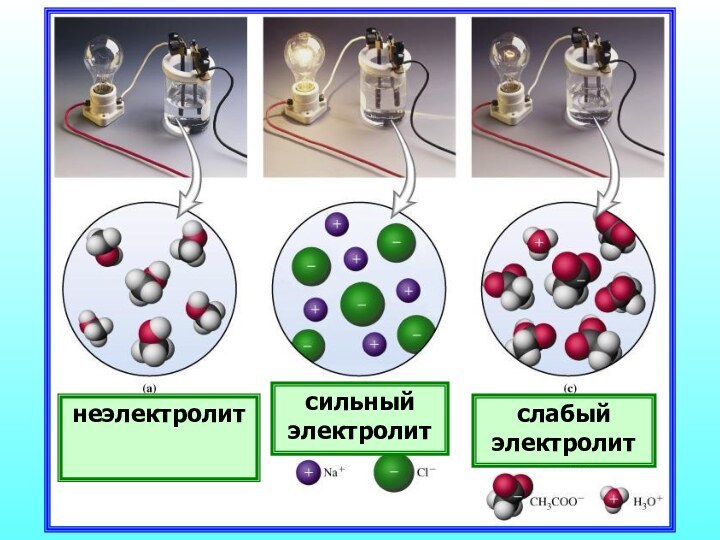
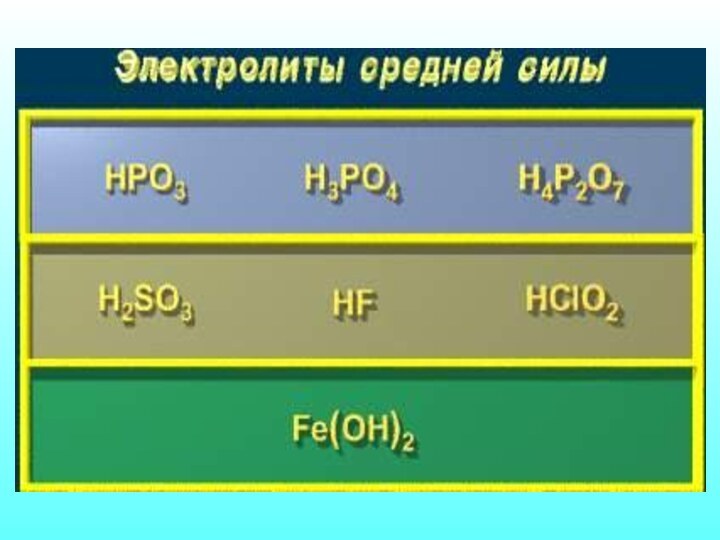
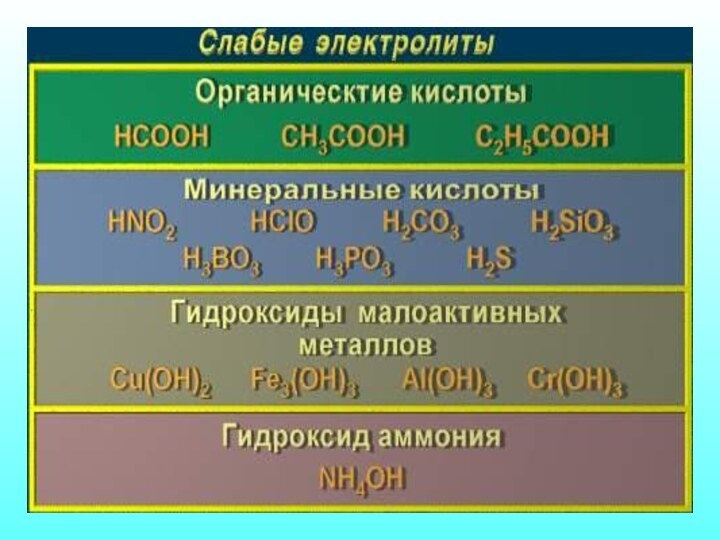
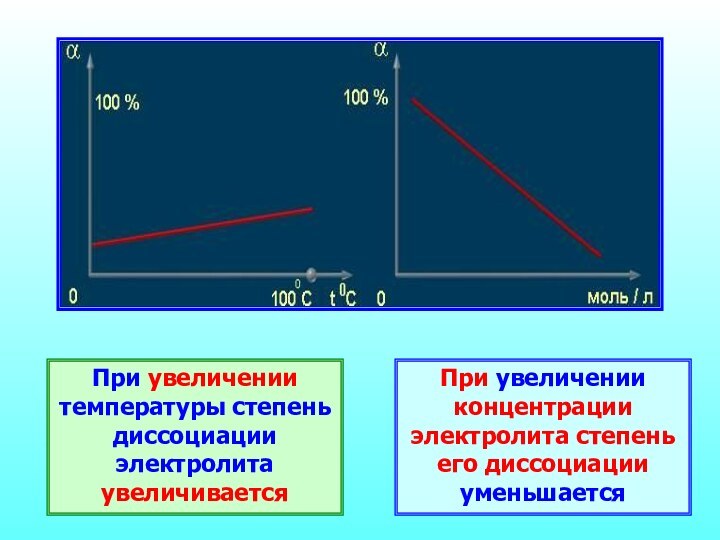
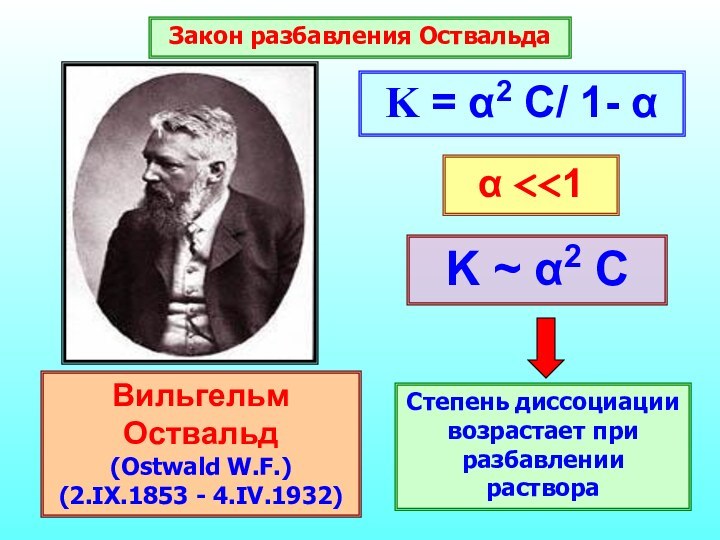
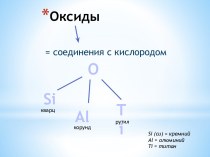
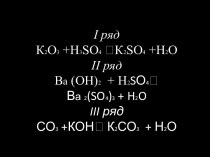Вещества
Электропроводность
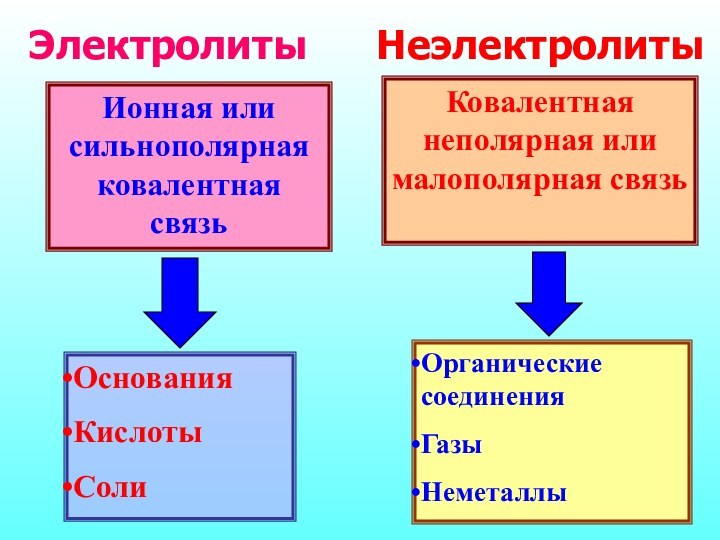
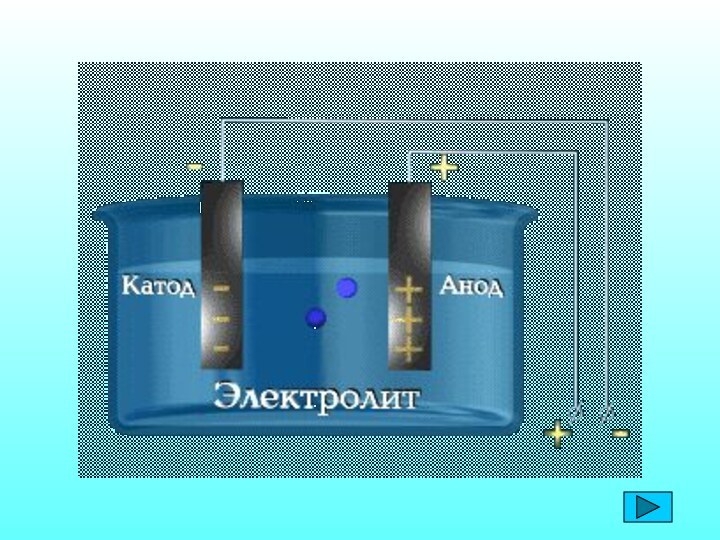
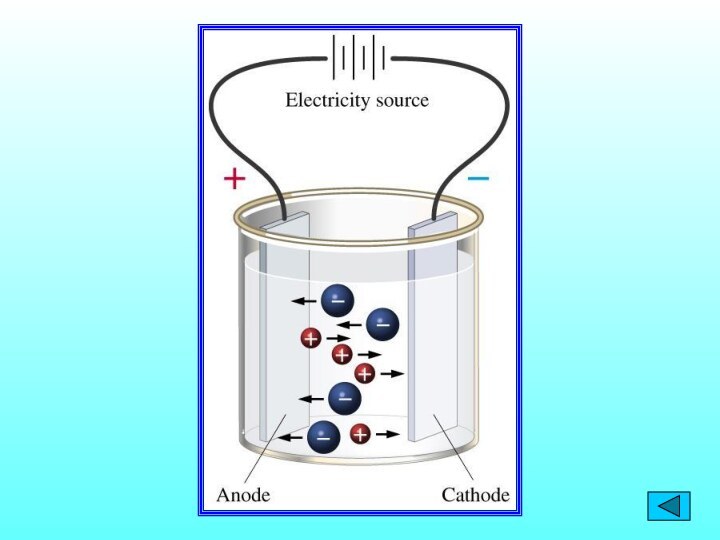
Электролиты
Неэлектролиты
вещества, растворы и расплавы которых не проводят электрический
ток