- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электролитическая диссоциация
Содержание
- 2. Цели урока Обобщить сведения об ионахЗакрепить умение
- 3. ПРОВЕРЬ СВОИ ЗНАНИЯВещества, растворы которых проводят электрический
- 4. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ(по степени электролитической диссоциации )
- 5. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
- 6. Расскажите о последовательности процессов, происходящих при
- 7. История открытия теории электролитической диссоциации В
- 8. Основные положения ТЭДПри растворении в воде электролиты
- 9. ИОНЫ – это положительно или отрицательно заряженные
- 10. ЭЛЕКТРОННЫЕ ФОРМУЛЫ+11Na0 2ē 8ē 1ē
- 11. ИОНЫ (по составу)ПРОСТЫЕНапример:Cl-K+СЛОЖНЫЕНапример:NO3-SO42-
- 12. Основные положения ТЭД2. Причиной диссоциации электролита в
- 13. ИОНЫ (по наличию водной оболочки)ГИДРАТИРОВАННЫЕНапример:
- 14. Основные положения ТЭД3. Под действием электрического тока
- 15. ИОНЫ (по знаку заряда)КАТИОНЫ положительно заряженные частицыАНИОН отрицательно заряженные частицы
- 16. Основные положения ТЭД 4. Электролитическая диссоциация –
- 17. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
- 18. ЭЛЕКТРОЛИТЫ(по степени диссоциации) СЛАБЫЕ
- 19. Основные положения ТЭД6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 20. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)КИСЛОТЫ
- 21. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации
- 22. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты,
- 23. КИСЛОТЫэлектролиты, которые при диссоциации образуют катионы водорода
- 24. Многоосновные кислоты диссоциируют ступенчатоH3PO4 (фосфорная кислота)1)
- 25. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ
- 26. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты,
- 27. ОСНОВАНИЯэлектролиты, которые при диссоциации образуют катионы металла
- 28. Многокислотные основания диссоциируют ступенчатоBa(OH)2 (гидроксид бария)1)
- 29. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ
- 30. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты,
- 31. СОЛИ электролиты, которые при диссоциации образуют
- 32. ПРОВЕРЬ СВОИ ЗНАНИЯ Пользуясь таблицей растворимости, приведите
- 33. Разложение хлорида меди электрическим током
- 34. ОЦЕНКИ ЗА УРОК
- 35. Скачать презентацию
- 36. Похожие презентации
Цели урока Обобщить сведения об ионахЗакрепить умение записывать процесс диссоциации при помощи химических знаков и формулСформулировать основные положения теории электролитической диссоциации




























Слайд 2
Цели урока
Обобщить сведения об ионах
Закрепить умение записывать процесс
диссоциации при помощи химических знаков и формул
теории электролитической диссоциации
Слайд 3
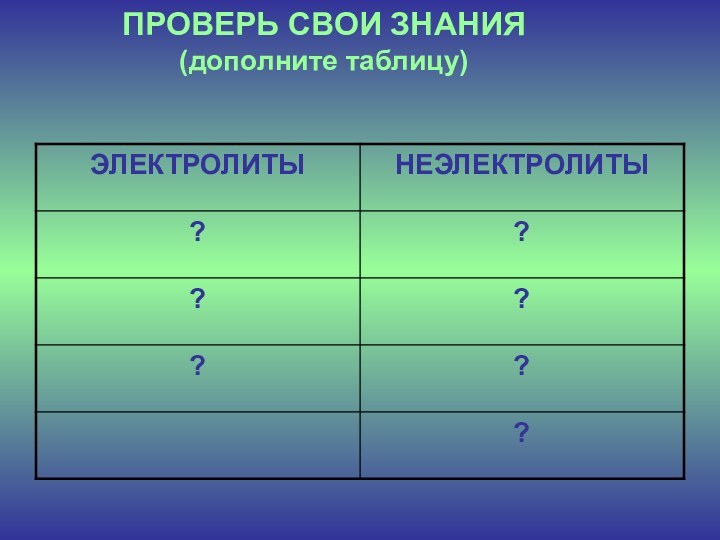
ПРОВЕРЬ СВОИ ЗНАНИЯ
Вещества, растворы которых проводят электрический ток,
называют ………
Процесс распада электролита на ионы называют ……..
Вещества, растворы
которых не проводят электрический ток, называют ……….Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют …………
Слайд 4
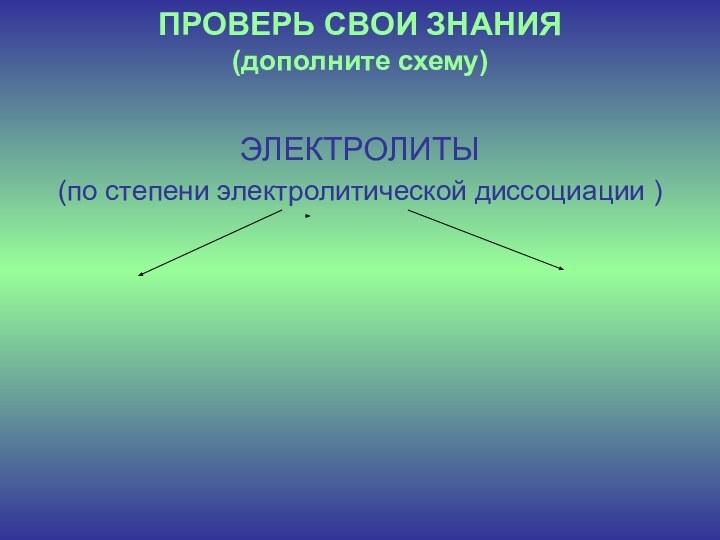
ПРОВЕРЬ СВОИ ЗНАНИЯ
(дополните схему)
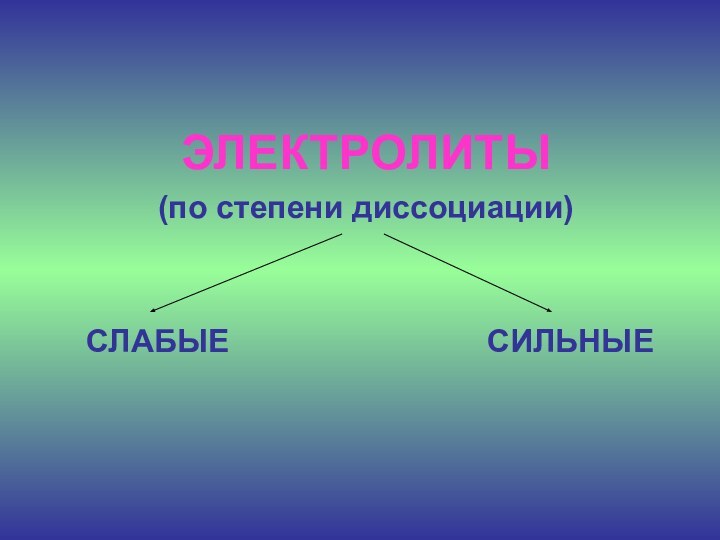
ЭЛЕКТРОЛИТЫ
(по степени электролитической диссоциации )
Слайд 6
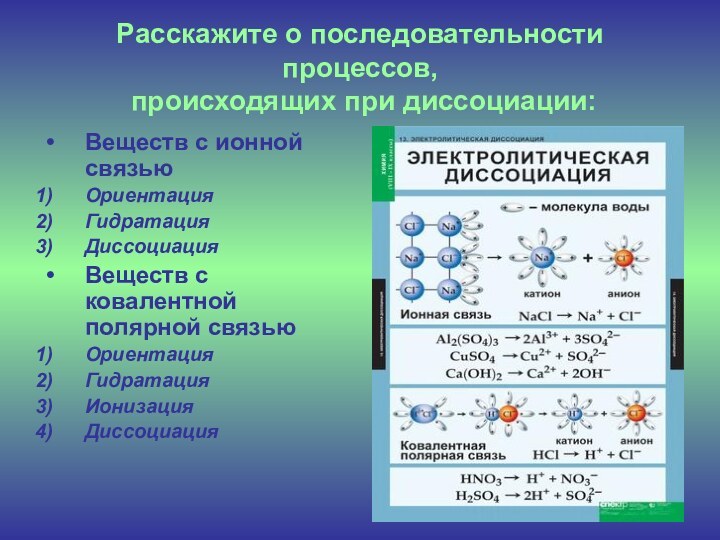
Расскажите о последовательности процессов,
происходящих при диссоциации:
Веществ с
ионной связью
Ориентация
Гидратация
Диссоциация
Веществ с ковалентной полярной связью
Ориентация
Гидратация
Ионизация
Диссоциация
Слайд 7
История открытия теории электролитической диссоциации
В 1887
году шведский химик Сванте Аррениус сформулировал основные положения теории
электролитической диссоциации
Слайд 8
Основные положения ТЭД
При растворении в воде электролиты диссоциируют
(распадаются) на положительные и отрицательные ионы.
NaCl = Na+ +
Cl-Ионы – это одна из форм существования химического элемента
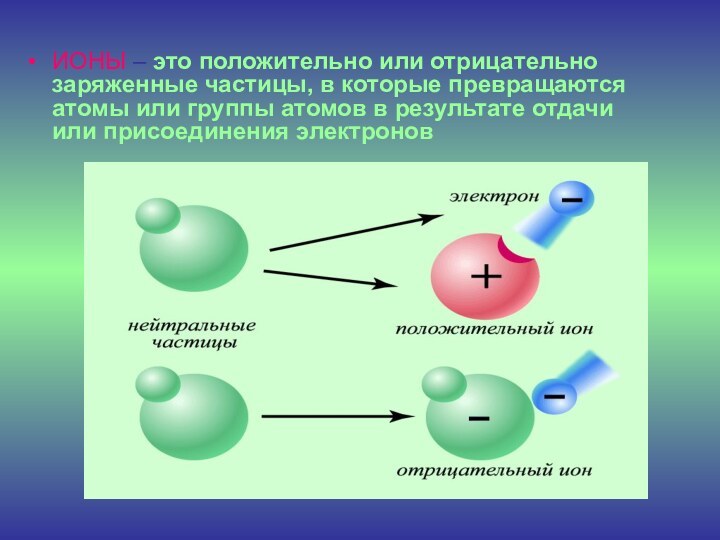
Слайд 9 ИОНЫ – это положительно или отрицательно заряженные частицы,
в которые превращаются атомы или группы атомов в результате
отдачи или присоединения электронов
Слайд 10
ЭЛЕКТРОННЫЕ ФОРМУЛЫ
+11Na0 2ē 8ē 1ē +11Na+
2ē 8ē
атом
ион+17Cl0 2ē 8ē 7ē +17Cl0 2ē 8ē 8ē
атом ион
Слайд 12
Основные положения ТЭД
2. Причиной диссоциации электролита в водном
растворе является его гидратация, т.е. взаимодействие электролита с молекулами
воды и разрыв химической связи в нем.
Слайд 13
ИОНЫ
(по наличию водной оболочки)
ГИДРАТИРОВАННЫЕ
Например:
В растворах
и кристаллогидратах CuSO4 * 5H2O
Na2SO4* 10H2O НЕГИДРАТИРОВАННЫЕ
Например:
В безводных солях
Cu2+SO42-
Na+NO3-
Слайд 14
Основные положения ТЭД
3. Под действием электрического тока
положительно заряженные ионы движутся к отрицательному полюсу источника тока
– катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, поэтому их называют анионами.
Слайд 15
ИОНЫ
(по знаку заряда)
КАТИОНЫ
положительно заряженные частицы
АНИОН
отрицательно заряженные частицы
Слайд 16
Основные положения ТЭД
4. Электролитическая диссоциация – процесс
обратимый для слабых электролитов.
Наряду с процессом диссоциации
протекает и обратный процесс – ассоциация (соединение ионов)HNO2 H+ + NO2-
Слайд 19
Основные положения ТЭД
6. Химические свойства растворов электролитов определяются
свойствами тех ионов, которые они образуют при диссоциации.
Слайд 21
ЗАДАНИЕ
Составьте возможные уравнения электролитической диссоциации веществ
в водных растворах.
1) HCl 2) HNO3 3) Н2SiO3
Слайд 23
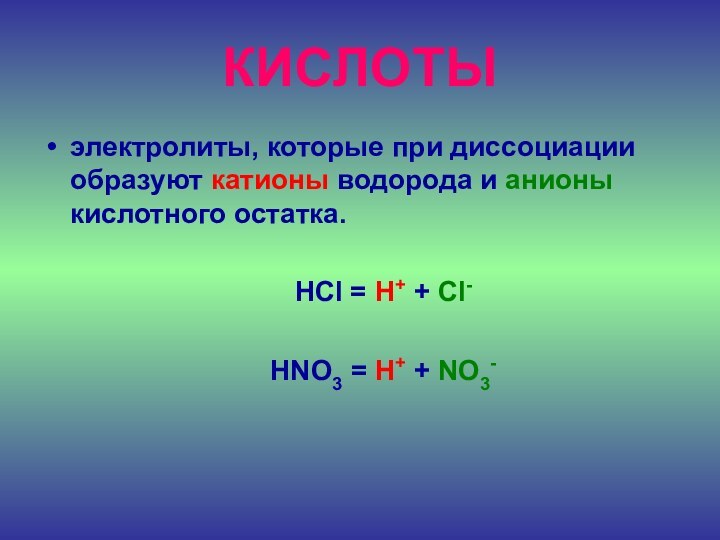
КИСЛОТЫ
электролиты, которые при диссоциации образуют катионы водорода и
анионы кислотного остатка.
HCl = H+ +
Cl-HNO3 = H+ + NO3-
Слайд 24
Многоосновные кислоты диссоциируют ступенчато
H3PO4 (фосфорная кислота)
1) Образование
дигидрофосфат-ионов
H3PO4 ↔ H+ + H2PO4-
2) Образование гидрофосфат-ионов
H2PO4- ↔ H+
+ HPO42-3) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
Слайд 25
ЗАДАНИЕ
Составьте возможные уравнения электролитической диссоциации веществ в
водных растворах.
1) NaOH 2) KOH 3) Fe(OH)2
Слайд 27
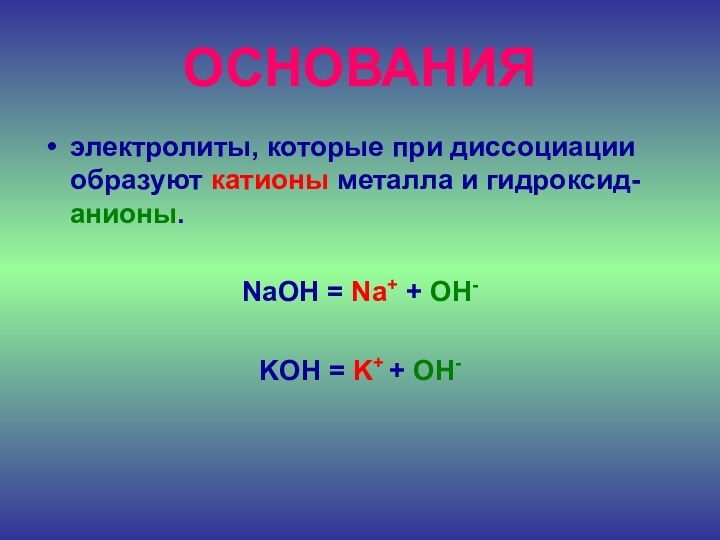
ОСНОВАНИЯ
электролиты, которые при диссоциации образуют катионы металла и
гидроксид-анионы.
NaOH = Na+ + OH-
KOH = K+ +
OH-
Слайд 28
Многокислотные основания диссоциируют ступенчато
Ba(OH)2 (гидроксид бария)
1) Образование
гидроксо-ионов бария
Ba(OH)2 ↔ OH- + BaOH+
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
Слайд 29
ЗАДАНИЕ
Составьте возможные уравнения электролитической диссоциации веществ в
водных растворах.
1) NaCl 2) KNO3 3) BaSO4
Слайд 31
СОЛИ
электролиты, которые при диссоциации образуют катионы
металла (или аммония NH4) и анионы кислотных остатков.
K3PO4
= 3K+ + PO43-NH4Cl = NH4+ + Cl-
Слайд 32
ПРОВЕРЬ СВОИ ЗНАНИЯ
Пользуясь таблицей растворимости, приведите примеры трех
веществ, которые в растворах образуют сульфат-ионы. Запишите уравнения электролитической
диссоциации этих веществ.1) H2SO4 ↔ H+ + HSO4-
2) HSO4- ↔ H+ + SO42-