- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электролиз (на примере электролиза расплава хлорида натрия и раствора хлорида меди (II)). Процессы, протекающие на катоде и аноде. Применение электролиза.
Содержание
- 2. Электролиз – окислительно-восстановительный процесс, происходящий на электродах
- 3. Катод – электрод, на котором при разложении
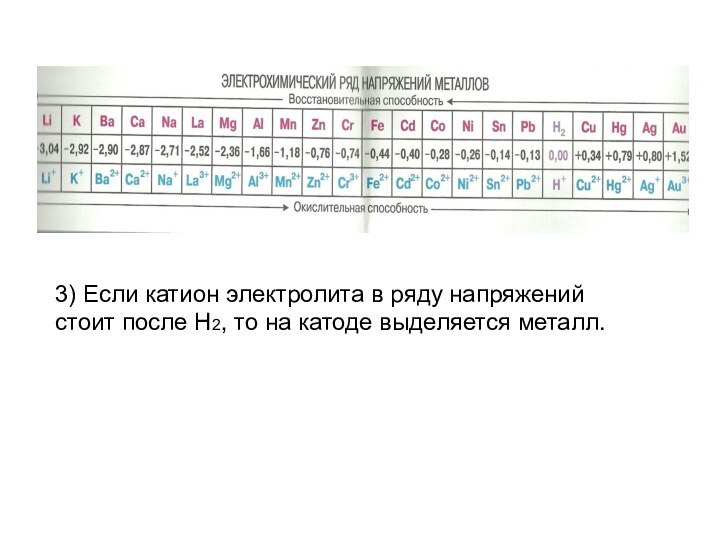
- 4. Процессы происходящие на катоде (смотри ряд напряжений
- 5. 3) Если катион электролита в ряду напряжений стоит после H2, то на катоде выделяется металл.
- 6. Процессы происходящие на анодеПри электролизе растворов солей
- 9. Применение электролиза Явление электролиза
- 10. Электролизом пользуются для покрытия металлических предметов никелем, хромом, цинком, оловом, золотом и т.д.
- 11. Электролиз находит применение в очистке воды –
- 12. Скачать презентацию
- 13. Похожие презентации
Электролиз – окислительно-восстановительный процесс, происходящий на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.










Слайд 2 Электролиз – окислительно-восстановительный процесс, происходящий на электродах при
пропускании постоянного электрического тока через раствор или расплав электролита.
Слайд 3 Катод – электрод, на котором при разложении вещества
электрическим током происходит восстановление.
Анод – электрод, на котором происходит
процесс окисления.Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду.
Отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Слайд 4
Процессы происходящие на катоде (смотри ряд напряжений металлов!)
Если
катион электролита расположен в ряду напряжений в начале ряда
по Al включительно, то на катоде выделяется H2.Если катион электролита в ряду напряжений расположен между Al и H2, то на катоде выделяется металл (~90%) и H2.
Слайд 5 3) Если катион электролита в ряду напряжений стоит
после H2, то на катоде выделяется металл.
Слайд 6
Процессы происходящие на аноде
При электролизе растворов солей безкислородных
кислот (кроме HF (фторидов)) на аноде образуются простые вещества.
При
электролизе раствора кислородосодержащих солей и фторидов на аноде выделяется О2.Слайд 7
Рассмотрим в качестве примера электролиз водного
раствора хлорида меди на инертных электродах. В растворе находятся ионы Cu2+ и Cl-, которые под действием электрического тока направляются к соответствующим электродам:CuCl2
↓
(-) Катод ← Cu2+ + 2Cl- → Анод (+) Cu2+ + 2e = Cu0 2Cl- - 2e = Cl2+
На катоде выделяется металлическая медь , на аноде — газообразный хлор.
Слайд 8
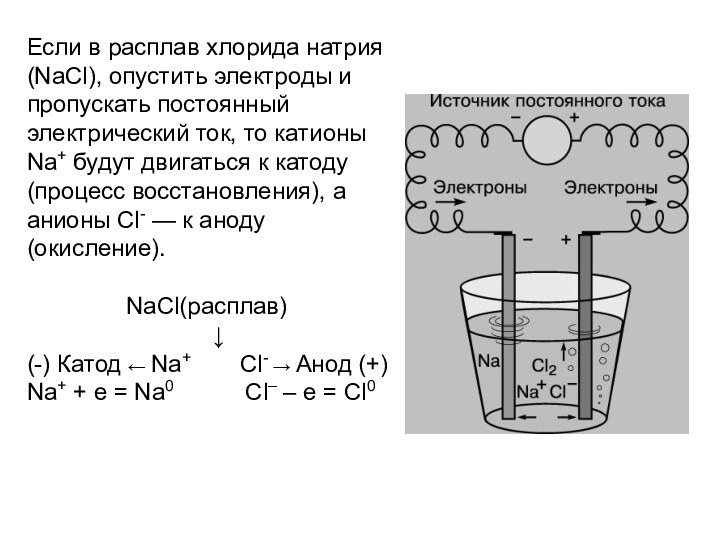
Если в расплав хлорида натрия (NaCl), опустить электроды и
пропускать постоянный электрический ток, то катионы Na+ будут двигаться к катоду (процесс восстановления), а анионы Cl- — к аноду (окисление). NaCl(расплав)
↓
(-) Катод ← Na+ Cl- → Анод (+)
Na+ + e = Na0 Cl– – e = Cl0