- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Типы химических реакций на примере свойств воды (8 класс)
Содержание
- 2. «Вода!.. Ты не просто необходима для жизни,
- 3. В
- 4. Вода необходима практически каждой клетке организма, ведь
- 5. Где же эта вода?Разные ткани человеческого организма
- 6. Живые организмы не могут существовать без воды!Вода
- 7. ВЫВОДЫ:Основная роль воды в организме - служить
- 8. Наша страна занимает 1-ое место в мире по запасам пресной воды.
- 9. Применение водыПрактически невозможно назвать какой-либо производственный процесс,
- 10. Водопотребление в ЖКХРасходы на хозяйственно-питьевое снабжение населения
- 11. Реакции разложенияТипы химических реакций на примере свойств воды
- 12. Электролиз – это совокупность окислительно-восстановительных процессов, протекающих
- 13. Электролиз водыЭлектролиз воды - выделение водорода -http://www.youtube.com/watch?v=9PATtoLz0oo&feature=related "Электролиз воды http://www.youtube.com/watch?v=nhiChlMWl_g&feature=related
- 14. Электролиз воды
- 16. Разложение воды на свету называют фотолизом.
- 17. Фотосинтез Глюкоза образуется в растениях в результате фотосинтеза: 6СО2 + 6Н2О
- 18. Кислород, которым зеленые растения обогащают атмосферу, образуется в процессе фотосинтеза
- 19. РЕАКЦИИ СОЕДИНЕНИЯ С ВОДОЙ
- 20. Взаимодействие с водой оксидов(оксиды щелочных
- 21. Гашение извести
- 24. ГидроксидыГидроксидами называют кислородсодержащие кислоты и основания.
- 25. FeO+H2O= SiO2+Н2O= ?
- 26. Кислотные оксиды Например:
- 27. Основные оксиды Например: Na2O –оксид натрия
- 28. РЕАКЦИИ ЗАМЕЩЕНИЯСа + 2Н2О = Са(ОН)2+ Н2
- 29. РЕАКЦИИ ОБМЕНА
- 30. ГидролизГидролиз – обменное взаимодействие веществ с водой,
- 31. Домашнее задание: §33, №3
- 32. Скачать презентацию
- 33. Похожие презентации
«Вода!.. Ты не просто необходима для жизни, ты и есть сама жизнь!…» А. де Сент – Экзюпери.






























Слайд 3 В кружева
будто одеты
Деревья, кусты,
провода.И кажется сказкою это,
А в сущности – только вода.
Безбрежная ширь океана
И тихая заводь пруда,
Струя водопада и брызги фонтана,
И всё это – только вода.
Слайд 4 Вода необходима практически каждой клетке организма, ведь почти
все биохимические реакции в живых клетках – реакции в
водных растворах. Человек примерно на 65% состоит из воды. С возрастом содержание воды в организме уменьшается. В женском теле воды меньше, чем в мужском, а в детском меньше, чем в женском.
Слайд 5
Где же эта вода?
Разные ткани человеческого организма содержат
разное количество воды. Самая богатая водой ткань – стекловидное
тело глаза (99 %). Самая бедная – эмаль зуба (0,2 %).
Слайд 6
Живые организмы не могут существовать без воды!
Вода входит
в состав клеток и тканей любого животного и растения.
Медузы состоят из 99,9% воды, взрослый человек – 70-80%.
Сложнейшие реакции организма протекают в водной среде, например, процесс пищеварения требует в сутки не менее 9-10 л воды.
Слайд 7
ВЫВОДЫ:
Основная роль воды в организме - служить растворителем
для веществ, участвующих в биохимических процессах, происходящих в живых
клетках.Водный обмен – важная составная часть общего обмена веществ человека.
Слайд 9
Применение воды
Практически невозможно назвать какой-либо производственный процесс, в
котором не использовалась бы вода. Промышленность нашей страны ежесекундно
потребляет столько воды, сколько несёт её Волга. Для получения 1кВт*ч электроэнергии требуется 200 куб.м воды!
Слайд 10
Водопотребление в ЖКХ
Расходы на хозяйственно-питьевое снабжение населения России
почти в 3 раза превышают соответствующий мировой показатель –
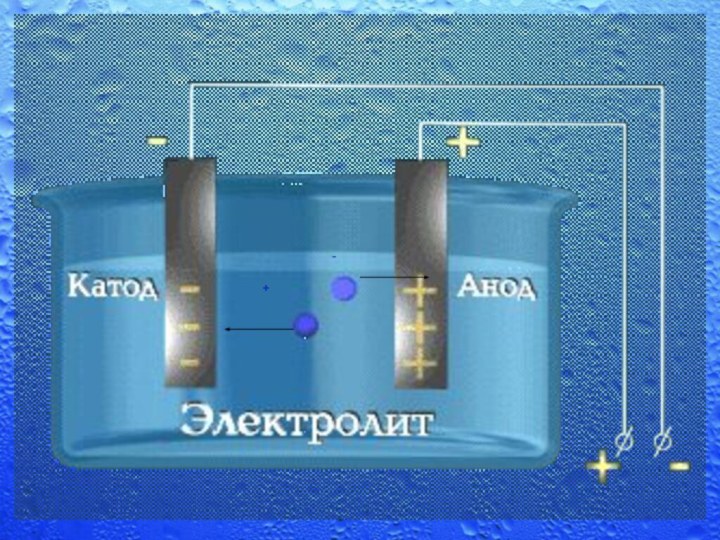
200 л/cут.Слайд 12 Электролиз – это совокупность окислительно-восстановительных процессов, протекающих на
электродах (катоде и аноде), если через раствор или расплав
электролита протекает постоянный электрический ток.Электролиз
Слайд 13
Электролиз воды
Электролиз воды - выделение водорода -http://www.youtube.com/watch?v=9PATtoLz0oo&feature=related
"Электролиз
воды http://www.youtube.com/watch?v=nhiChlMWl_g&feature=related
Слайд 17
Фотосинтез
Глюкоза образуется в растениях в результате
фотосинтеза:
6СО2 + 6Н2О
С6Н12О6 + 6О2
свет, хлорофилл
Механизм фотосинтеза-http://www.youtube.com/watch?v=hBW25QdCLgI&feature=fvwrel
Флеш-ролик - http://cnit.ssau.ru/organics/chem4/fotosint.htm
Слайд 20
Взаимодействие с водой оксидов(оксиды щелочных и
щелочноземельных металлов):
CaO+H2O=Ca(OH)2
Li2O+Н2O=2LiOН
?
Слайд 26
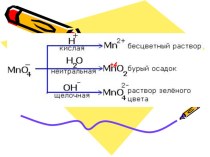
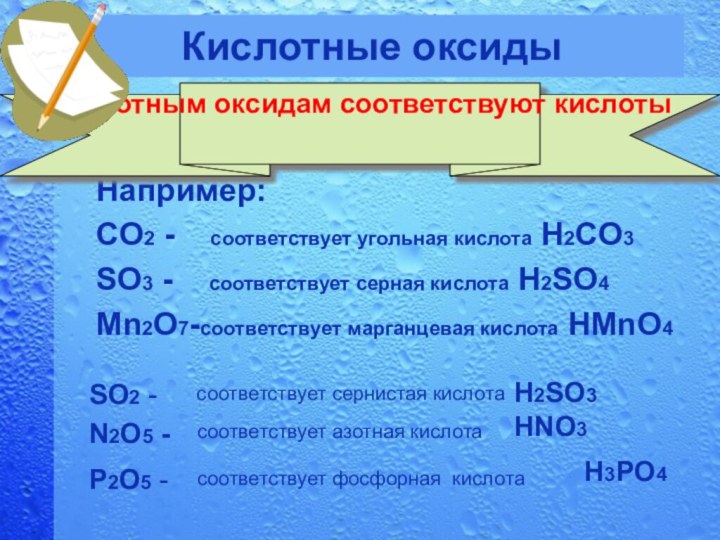
Кислотные оксиды
Например:
CO2 - соответствует угольная кислота H2CO3
SO3 - соответствует серная кислота H2SO4 Mn2O7-соответствует марганцевая кислота HMnO4
SO2 -
H2SO3
соответствует сернистая кислота
N2O5 -
соответствует азотная кислота
HNO3
H3РO4
Р2O5 -
соответствует фосфорная кислота
Кислотным оксидам соответствуют кислоты
Слайд 27
Основные оксиды
Например:
Na2O –оксид натрия
соответствует
гидроксид натрия NaOН
CаO–оксид кальция
соответствует гидроксид кальция Cа(OН)2
Основные
оксиды – это оксиды металлов со степенью окисления +1, +2 , им соответствуют основания
Слайд 30
Гидролиз
Гидролиз – обменное взаимодействие веществ с водой, приводящее
к их разложению.
Al2S3 + 6H2O →
2Al(OH)3↓ + 3H2S↑CaC2 + 2H2O = Ca(OH)2 + C2H2↑