Слайд 2
С В О Й С Т В А
Ф Е Р М Е Н Т О В
1.
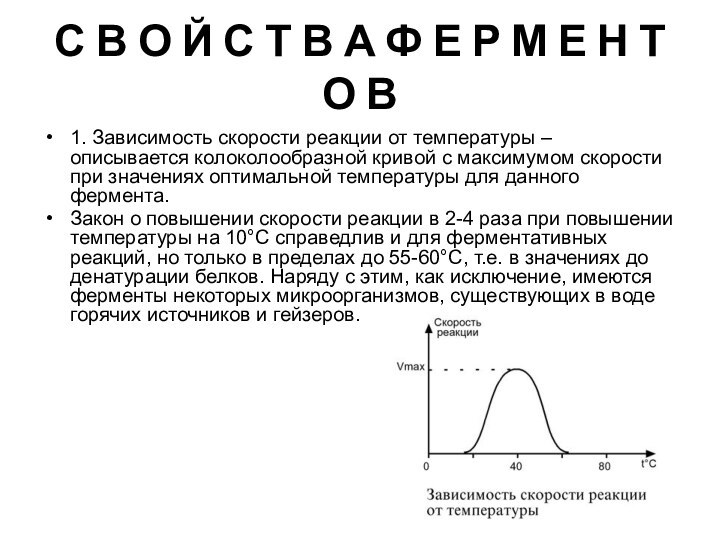
Зависимость скорости реакции от температуры – описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента.
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. в значениях до денатурации белков. Наряду с этим, как исключение, имеются ферменты некоторых микроорганизмов, существующих в воде горячих источников и гейзеров.
Слайд 3
У сиамских кошек мордочка, кончики ушей, хвоста, лапок
черного цвета. В этих областях температура всего на 0,5°С
ниже, чем в центральных областях тела. Но это позволяет работать ферменту, образующему пигмент в волосяных луковицах. При малейшем повышении температуры фермент инактивируется.
У зайца-беляка при понижении температуры окружающего воздуха пигментообразующий фермент кожи инактивируется, и заяц получает белую шубку.
Противовирусный белок интерферон начинает синтезироваться в клетках только при достижении температуры тела 38°С
Слайд 4
При понижении температуры активность ферментов понижается, но не
исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных
(суслики, ежи), температура тела которых понижается до 3-5°С.
Это свойство ферментов также используется в хирургической практике при проведении операций на грудной полости, когда больного подвергают охлаждению до 22°С.
Слайд 5
2. Зависимость скорости реакции от рН – описывается
колоколообразной кривой с максимумом скорости при оптимальном для данного
фермента значении рН.
Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности.
Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0.
Слайд 6
3. Зависимость скорости реакции от концентрации субстрата
При увеличении
концентрации субстрата скорость реакции сначала возрастает соответственно подключению к
реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата.
При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермент и скорость реакции снижается.
Слайд 7
4. Зависимость от концентрации фермента
При увеличении количества молекул
фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству
фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.
Слайд 8
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Специфичность основана на комплементарности структуры субстрата и
активного центра фермента.
1. Стереоспецифичность – катализ только одного из
стереоизомеров, например:
специфичность к L- или D-аминокислотам – например, почти все ферменты млекопитающих взаимодействуют с L-аминокислотами,
специфичность к цис- и транс-изомерам. Например, аспартаза реагирует только с транс-изомером – фумаровой кислотой, но не с малеатом (цис-изомер)
Слайд 9
2. Абсолютная специфичность – фермент производит катализ только
одного вещества. Например, расщепление мочевины уреазой.
Слайд 10
3. Групповая специфичность – катализ субстратов с общими
структурными особенностями, т.е. при наличии определенной связи или химической
группы:
- наличие пептидной связи, например, бактериальный фермент субтилизин специфичен к пептидной связи независимо от строения образующих ее аминокислот,
пепсин катализирует разрыв пептидной связи, образованной карбоксильными группами ароматических аминокислот,
• тромбин расщепляет пептидную связь только между аргинином и глицином.
- наличие ОН-группы, например, алкогольдегидрогеназа окисляет до альдегидов одноатомные спирты (этанол, метанол, пропанол).
Слайд 11
4. Относительная групповая специфичность – превращение субстратов с
некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные
вещества, которых насчитывается около 7000.
Слайд 12
МЕХАНИЗМЫ СПЕЦИФИЧНОСТИ
В общем виде все сводится к комплементарному
взаимодействию фермента и субстрата. При этом функциональные группы субстрата
взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы:
Слайд 13
1. Гипотеза Фишера (модель "жесткой матрицы", "ключ-замок") –
активный центр фермента строго соответствует конфигурации субстрата и не
изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.
Слайд 14
2. Гипотеза Кошланда (модель "индуцированного соответствия", "рука-перчатка") –
подразумевает гибкость активного центра. Присоединение субстрата к якорному участку
фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.
Слайд 15
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ IN VIVO
Активность ферментов в клетке
непостоянна во времени. Она чутко реагирует на ситуацию, в
которой оказывается клетка, на факторы, воздействующие на клетку как снаружи, так и изнутри.
Главная цель этой реакции – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – получить шанс выжить.
Слайд 16
1. Компартментализация.
Компартментализация – это сосредоточение ферментов и их
субстратов в одном компартменте (одной органелле) – в эндоплазматическом
ретикулуме, митохондриях, лизосомах.
Например, β-окисление жирных кислот протекает в митохондриях, синтез белка – в рибосомах.
Слайд 17
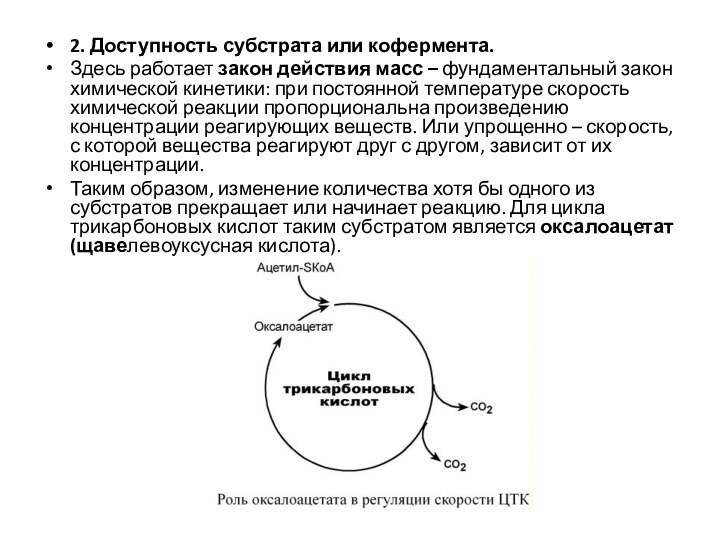
2. Доступность субстрата или кофермента.
Здесь работает закон действия
масс – фундаментальный закон химической кинетики: при постоянной температуре
скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно – скорость, с которой вещества реагируют друг с другом, зависит от их концентрации.
Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию. Для цикла трикарбоновых кислот таким субстратом является оксалоацетат (щавелевоуксусная кислота).
Слайд 18
3. Изменение количества фермента.
Изменение количества фермента может происходить
в результате увеличения или снижения его синтеза. Изменение скорости
синтеза фермента обычно зависит от количества определенных гормонов или субстратов реакции.
Например, гормон кортизол стимулирует синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови и устойчивость ЦНС к стрессу. При беременности и после родов под воздействием лактотропного гормона в молочной железе активно идет синтез фермента лактозосинтазы.
Исчезновение пищеварительных ферментов при длительном голодании и их появление в восстановительный период (в результате изменения секреции кишечных гормонов).
Этанол стимулирует в печени синтез "своего" (обезвреживающего спирт) изофермента цитохрома Р450.
Слайд 19
4. Ограниченный (частичный) протеолиз проферментов.
Т.к. синтез некоторых ферментов
осуществляется в виде более крупного предшественника (трипсиноген, пепсиноген, прокарбоксипептидазы,
факторы свертывания крови), то при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов.
Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок до наступления определенного момента (протромбин, фибриноген, белки комплемента).
Слайд 20
5. Аллостерическая регуляция.
Аллостерические ферменты построены из двух и
более субъединиц: одни субъединицы содержат каталитический центр, другие являются
регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и активность каталитической субъединицы.
Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами.
В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса, продукт данной реакции, т.е работать механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой положительной регуляции. Также регулятором могут быть метаболиты взаимосвязанного пути.
Фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада.
Слайд 22
6. Белок-белковое взаимодействие.
Термин белок-белковое взаимодействие обозначает ситуацию, когда
в качестве регулятора выступают не метаболиты биохимических процессов, а
специфичные белки. Влияние каких-либо факторов на эти белки изменяет их активность, и они, в свою очередь, воздействуют на нужный фермент.
Слайд 24
К примеру, мембранный фермент аденилатциклаза является чувствительным к
воздействию мембранного G-белка, который сам активируется при действии на
клетку некоторых гормонов (например, адреналина и глюкагона).
Другим примером белок-белкового взаимодействия может быть регуляция активности протеинкиназы А. Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ. Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются.
Слайд 25
7. Ковалентная (химическая) модификация.
Ковалентная модификация заключается в обратимом
присоединении или отщеплении определенной группы, благодаря чему изменяется активность
фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина, треонина, тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
Слайд 26
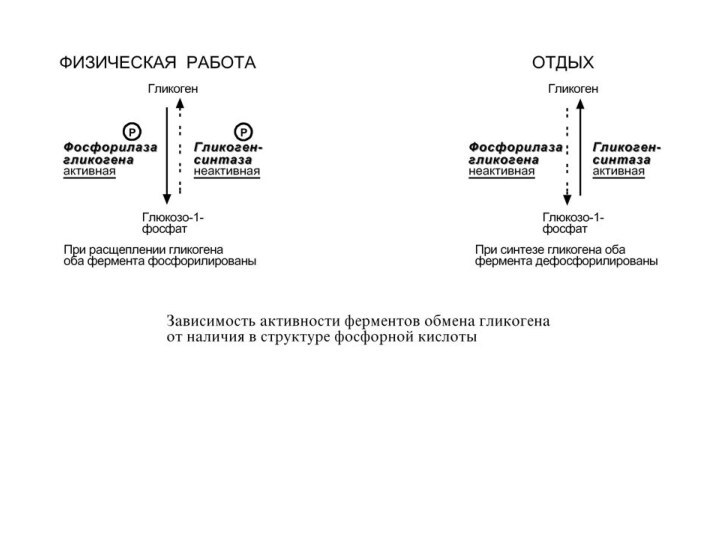
Ферменты могут быть активны как в фосфорилированном, так
и в дефосфорилированном состоянии.
Например, ферменты гликогенфосфорилаза и гликогенсинтаза при
потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.