1s2
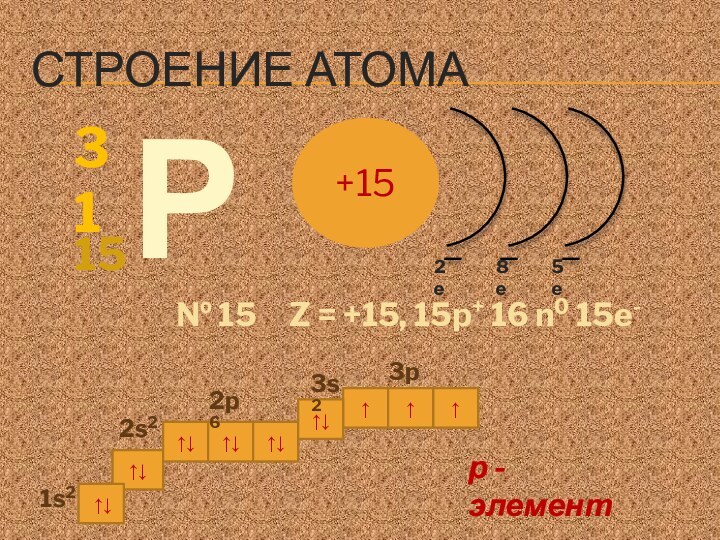
Строение атома
2e
5e
8e
р - элемент
↑↓
↑
3p3
2p6
↑
2s2
3s2
Р
15
31
+15
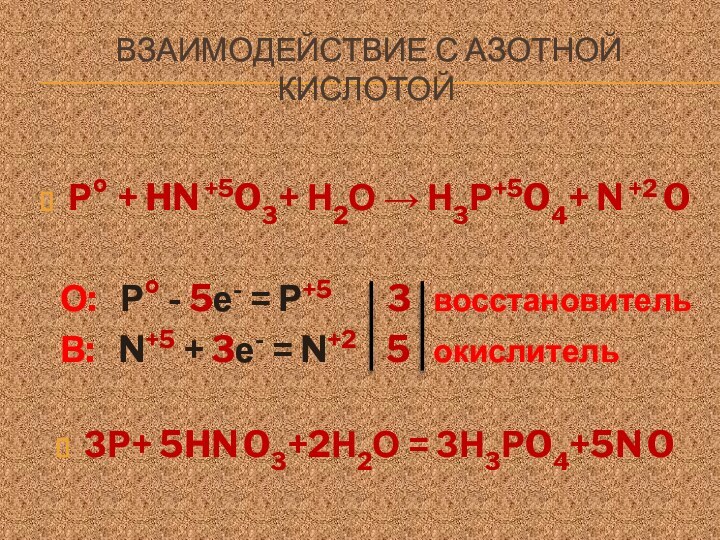
№ 15 Z = +15, 15p+ 16 n0 15e-
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






















↑
3p3
2p6
↑
2s2
3s2
Р
15
31
+15
№ 15 Z = +15, 15p+ 16 n0 15e-
белый при t = 40°С
красный при t = 260°С
черный при t = 400°С
Существует несколько гипотез возникновения загадочных огней. По одной из них - это самовозгорание газообразного
фосфористого водорода
образующегося при гниении отмерших растительных и животных организмов
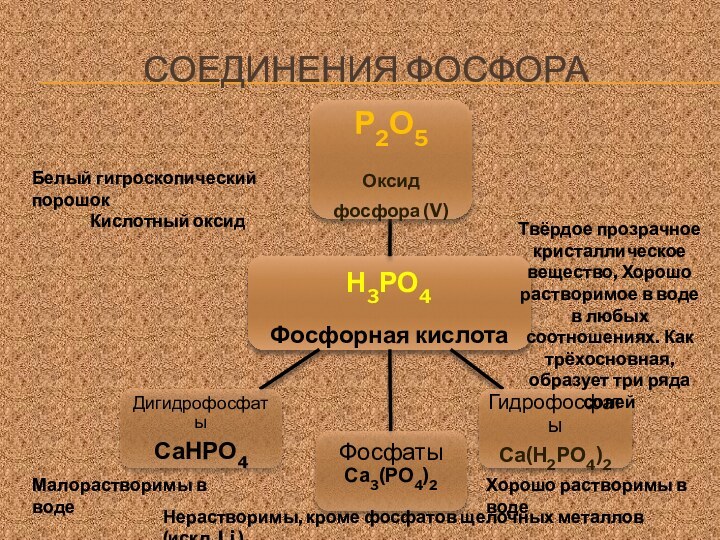
Нерастворимы, кроме фосфатов щелочных металлов (искл. Li )
Хорошо растворимы в воде
Малорастворимы в воде