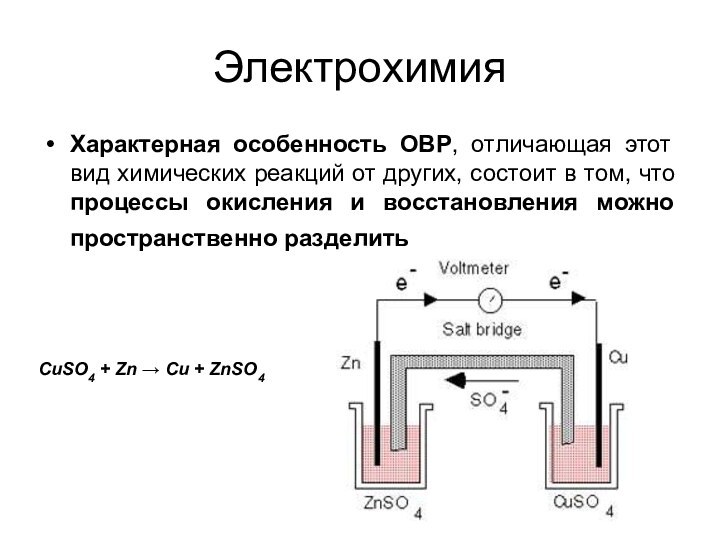
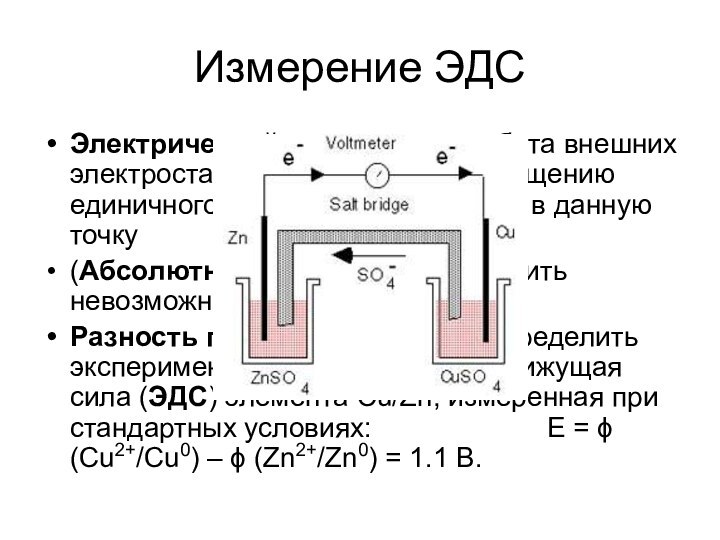
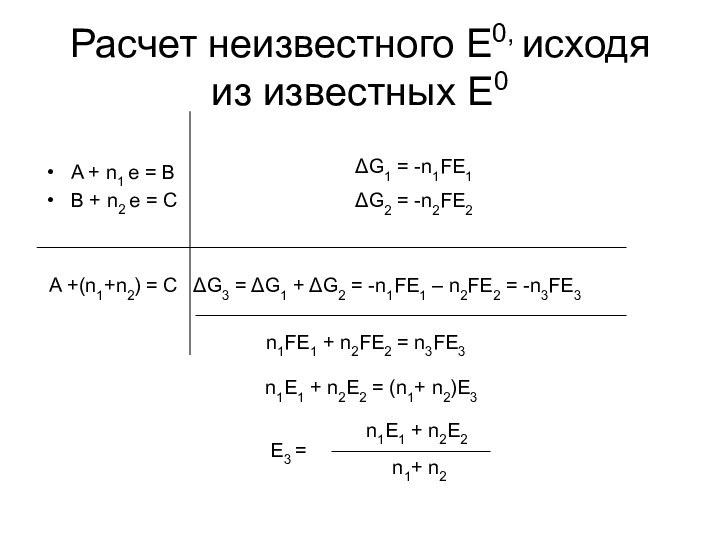
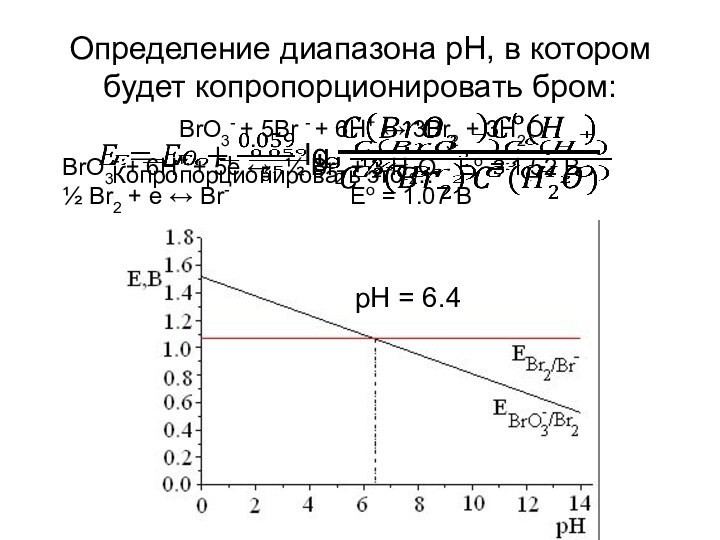
частице равна заряду этой частицы (в простых веществах СО
всех атомов равна 0).
В соединениях более электроотрицательным атомам соответствует более низкая СО.
Атомы, приведённые в таблице, в большинстве своих соединений проявляют постоянную СО. При определении СО предпочтение отдают элементу, который располагается в таблице выше. Например, в CaO2: СО(Сa)= +2, СО(О)= -1.
Максимальная СО равна номеру группы (короткий вариант ПС), кроме элементов, входящих в VIIIБ и IБ-подгруппы, и некоторых f-элементов. Минимальная СО неметаллов = Nгруппы-8. Например: Mn7+, P5+, P3-, S6+, S2-.
предпочтение отдают элементу, который располагается в таблице выше