- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Окислительно-восстановительные реакции
Содержание
- 2. Окислительно-восстановительные реакции
- 3. Студент должен:Знать:Основные положения теории окислительно-восстанови-тельных реакцийУметь:Составлять уравнения, расставлять коэффициенты, определять окислитель и восстановитель
- 4. Окислительно-восстановительные реакции протекают с изменением степеней
- 5. Степень окисления в отличие от валентности имеет
- 6. Для правильного составления уравнений окислительно-восстановительных реакций
- 7. Большинство элементов могут проявлять переменную степень
- 8. Окисление – это процесс отдачи электронов атомами,
- 9. Вещество, в состав которого входит вливающийся
- 10. Окислительно-восстановительные реакции делятся на три группы: 1.Межмолекулярные реакции.
- 11. 2. Внутримолекулярные реакции. В этих реакциях
- 12. 3. Реакции диспропорционирования (самоокисления и самовосстановления).
- 13. Установить формулы исходных веществ и продуктов реакции.Определить
- 14. Взаимодействие сульфата железа (2) с перманганатом калия
- 15. 2. Определим число электронов отданных восстановителем и
- 16. 3.Определим коэффициенты при исходных веществах и
- 17. Окисление и восстановление - две стороны единого
- 18. Атомы s- и d-элементов в своей низшей
- 19. Атом элемента в своей высшей степени окисления
- 20. Если атом элемента находиться в своей
- 21. Изменение окислительно-восстановительных свойств выглядит следующим образом:
- 22. Число групп SO4-2 в правой части стало
- 23. Это окончательное уравнение. Для проверки достаточно подсчитать
- 24. Пример.1) Zn0 + H2+SO4 (разб) → Zn+2SO4
- 26. Реакции со сложными ионами в различных средах. Взаимодействие
- 27. Записать эти частицы претерпевшие изменения, т.е. незавершенные
- 28. SO3-2 + H2O → SO4-2 + 2H+
- 29. MnO4-1 + 16H+ + 5SO3-2 + 5H2O→
- 30. Заряд левой части равен заряду правой части
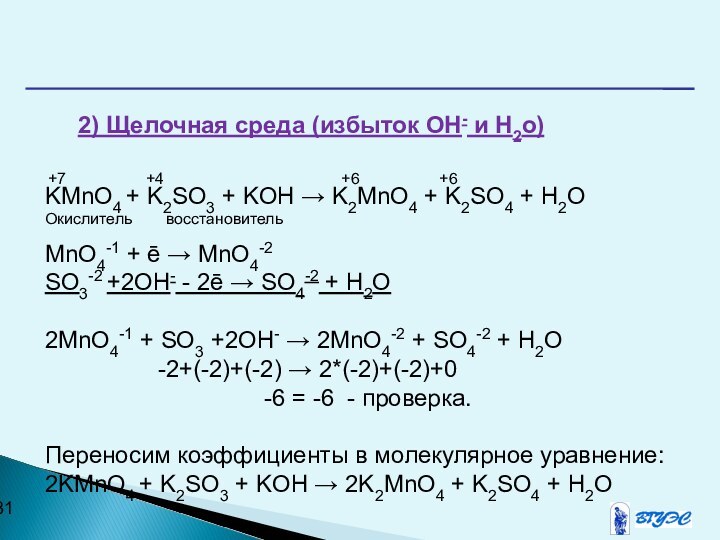
- 31. 2) Щелочная среда (избыток OH- и H2o)
- 32. Итак, в щелочной среде каждая недостающая частица
- 33. 3) Нейтральная среда (HOH) В нейтральной среде каждая
- 34. 2MnO4-1 +4H2O+3SO3-2 +3H2O→2MnO2 +8OH- +3SO4-2 +6H+2MnO4-1 +
- 35. +7 -2
- 36. 2Mn+7 + 4ē → Mn+4 + Mn+6
- 37. В одном и том же веществе окислитель
- 38. К окислительно-восстановительным реакциям относятся реакции разложения нитратов
- 39. Пример: Разложение нитрата кальция
- 40. Разложение нитрата серебра:+1 +5 -2
- 41. Скачать презентацию
- 42. Похожие презентации
Окислительно-восстановительные реакции






































Слайд 3
Студент должен:
Знать:
Основные положения теории окислительно-восстанови-тельных реакций
Уметь:
Составлять уравнения, расставлять
коэффициенты, определять окислитель и восстановитель
Слайд 4 Окислительно-восстановительные реакции протекают с изменением степеней окисления
атомов элементов, входящих в состав молекул реагирующих веществ.
Степень
окисления – это условный заряд атома в молекуле, вычисленный на основании предположения, что молекула состоит только из ионов.Следует различать понятия «степень окисления» и «валентность».
Валентность элемента определяется числом неспаренных электронов на внешнем энергетическом уровне атома (для s- и p-элементов) или на внешнем и предвнешнем незавершенном уровне атома (для d-элементов). Это число электронов атома, участвующих в образовании валентных связей.
Слайд 5 Степень окисления в отличие от валентности имеет положительное,
отрицательное и нулевое значение. Часто степень окисления атома численно
равна валентности, например, в молекуле HCL валентность атома хлора равна 1, а степень окисления – 1, но иногда может и не совпадать, так, в молекуле CL валентность хлора равна 1, а степень окисления – нулю.Слайд 6 Для правильного составления уравнений окислительно-восстановительных реакций необходимо
правильно определять величину и знак степени окисления любого атома
в молекуле. Для этого следует руководствоваться следующими положениями:а) степень окисления атома элемента в молекуле простого вещества равна нулю;
б) степень окисления атома водорода во всех соединениях , кроме гидридов щелочных и щелочно-земельных металлов, равна +1;
в) степень окисления атома кислорода во всех соединениях, кроме пероксидных и OF2, равна -2;
г) атомы большинства металлов, обладающих значением электроотрицательности, меньшей 2,1, во всех соединениях проявляют только положительные степени окисления;
д) сумма степеней окисления всех атомов в молекуле равна нулю.
Слайд 7 Большинство элементов могут проявлять переменную степень окисления
в соединениях.
Например, рассчитать степень окисления азота в соединениях KNO2
и HNO3+1 x -2
KNO2 +1+Χ+(-2)*2=0 Χ=+3
+1 x -2
HNO3 +1+Χ+(-2) *3=0 Χ=+5
Слайд 8 Окисление – это процесс отдачи электронов атомами, молекулами
или ионами.
Восстановление – это процесс присоединения электронов. Любая
окислительно-восстановительная реакция состоит из процессов окисления и восстановления. При окислении степень окисления элемента повышается, при восстановлении – понижается. Вещество, в состав которого входит окисляющийся элемент, называют восстановителем;
Слайд 9 Вещество, в состав которого входит вливающийся элемент,
- окислителем.
К типичным восстановителям относятся простые вещества, атомы
которых имеют малую электроотрицательность (металлы, водород, углерод, анионы, находящиеся в низкой или низшей степени окисления). К типичным окислителям относятся простые вещества, атомы которых характеризуются высокой электроотрицательностью (галогены, кислород), катионы и анионы, содержащие атомы в высокой степени окисления (Fe+3, Pb+4, C2O4-1, MnO4-1, ClO4-1 ).
Слайд 10
Окислительно-восстановительные реакции делятся на три группы:
1.Межмолекулярные реакции.
В
этих реакциях участвуют разные вещества. Например:
+4 -2C0 + O20 = CO2
C0 – 4ē → C+4
O20 + 4ē → 2O-2
C0 – Восстановитель
O20 – Окислитель
Слайд 11
2. Внутримолекулярные реакции.
В этих реакциях окислитель
и восстановитель в одной и той же молекуле, но
разные атомы выполняют функции окислителя и восстановителя. Обычно это реакции разложения. Например:-4 +1
CH4 → C0+ H20
C-4 - 4ē → C0
2H+1 + 2ē → H20
C-4 - восстановитель
H+1 – окислитель
Слайд 12 3. Реакции диспропорционирования (самоокисления и самовосстановления). В
этих реакциях происходит окисление и восстановление атомов и ионов
одного и того же элемента. Например:+6 +7 +4
H2MnO4 → HMnO4 + MnO2 + H2O
Слайд 13
Установить формулы исходных веществ и продуктов реакции.
Определить степень
окисления в исходных веществах и продуктах реакции.
Определить число электронов
отданных восстановителем и принимаемых окислителем и коэффициенты при восстановителе и окислителе. Определить коэффициенты при исходных веществах и продуктах реакции, исходя из баланса атомов в левой и правой части уравнений.
Слайд 14
Взаимодействие сульфата железа (2) с перманганатом калия в
кислой среде (H+ ).
1.Напишем уравнение реакции. Расставим степени
окисления. +1 +7 -2 +6 -2 +1 +6 -2 +3 +6 -2
KMnO4 + FeSO4 + H2SO4 → K2SO4 + Fe2 (SO4)3 +
+2 +6 -2
MnSO4 +H2O
+7 +2
Mn → Mn – степень окисления понижается
+2 +3
Fe → Fe – степень окисления повышается
Слайд 15 2. Определим число электронов отданных восстановителем и принимаемых
окислителем, а также коэффициенты при восстановителе и окислителе:
+7
+2Mn + 5 ē → Mn
+2 +3
Fe – ē → Fe
Слайд 16 3.Определим коэффициенты при исходных веществах и продуктах
реакции, исходя из баланса атомов в левой и правой
части уравнений.KMnO4 + 2FeSO4 → Fe2 (SO4)3 + MnSO4
окислитель восстановитель
+ 5 ē – 2ē
Число отданных и принятых электронов должно быть равно. Наименьшее общее кратное 5 и 2 равно 10. Ищем коэффициент:
2KMnO4 + 10FeSO4 → K2SO4 + 5Fe2(SO4)3 + 2MnSO4
+10 ē -10 ē
Слайд 17 Окисление и восстановление - две стороны единого процесса,
и в соответствие с законом сохранения массы количество электронов,
отданных восстановителем, равно количеству электронов, принятых окислителем. Для отражения окислительно-восстановительного процесса составляют электронные уравнения.О том, какими свойствами (окислительными или восстановительными) обладает данное вещество, можно судить на основании степени окисления элемента в данном соединении.
Слайд 18 Атомы s- и d-элементов в своей низшей степени
окисления (нулевой) имеют на внешнем энергетическом уровне 1-2 электрона.
Атомы p-элементов 4-7 групп в своей низшей степени окисления на внешнем энергетическом уровне имеют 8 электронов.
И в том и в другом случае атом элемента в своей низшей степени окисления не может принимать электроны и является только восстановителем.
Слайд 19 Атом элемента в своей высшей степени окисления не
имеет ни одного валентного электрона (у атомов s- и
p-элементов отданы все электроны внешнего энергетического уровня, у атомов d-элементов и част электронов с предвнешнего слоя недостроенного d-подуровня).Следовательно, дальнейшая отдача электронов таким атомом невозможна, и атом элемента в своей высшей степени окисления может быть только окислителем.
Слайд 20 Если атом элемента находиться в своей промежуточной
степени окисления, то возможны как процесс дальнейшей отдачи электронов,
так и процесс присоединения, т.е. атом обладает окислительно-восстановительной двойственностью – возможностью вступать в реакции как с восстановителями, так и с окислителямиСлайд 22 Число групп SO4-2 в правой части стало на
8 больше, чем в левой части уравнения, поэтому для
материального баланса по группам SO4-2 надо добавить в левую часть уравнения 8 молекул H2SO4:2KMnO4 + 10FeSO4 + 8H2SO4 → K2SO4 + 5Fe2 (SO4)3 + 2MnSO4
Считаем сколько атомов водорода в левой части уравнения и в правой части. В левой 16 атомов водорода, в правой части их нет совсем. Для соблюдения материального баланса по водороду в правую часть добавляем 8 молекул воды:
2KMnO4 + 10FeSO4 + 8H2SO4→ K2SO4 + 5Fe2(SO4)3 + 2MnSO4 +8H2O
Слайд 23 Это окончательное уравнение. Для проверки достаточно подсчитать число
атомов водорода и кислорода в каждой части уравнения. Если
числа совпадают, то уравнение составлено верно.Этот многоступенчатый метод составления уравнений окислительно-восстановительных реакций приведен для понимания логики решения многих задач.
Слайд 24
Пример.
1) Zn0 + H2+SO4 (разб) → Zn+2SO4 +
H20
Zn0 - 2 ē → Zn+2
2H+ + 2 ē
→ H20Zn0 + 2H+→ Zn+2 + H20
+2 = +2 – проверка
2) Fe0 + 2H+1CL(разб) → Fe+2CL2 + H20↑
Fe0 - 2ē → Fe+2
2H+1 + 2ē → H20
Fe0 + 2H+1 →Fe+2 + H20
+2 = +2
Слайд 25
+6
+3 +43) 2Fe0 + 6H2SO4 (конц)→Fe2(SO4)3 + 3SO2 + 6H2O
Fe0 - 3ē → Fe+3
S+6 + 2ē → S+4
2Fe0 + 3S+6 →2Fe+3 + 3S+4
0 + 18 + 6 + 12
+ 18 = + 18
Для соблюдения электронного баланса ищем дополнительные множители
Слайд 26
Реакции со сложными ионами в различных средах.
Взаимодействие перманганата
калия с сульфатом калия в разных средах.
1) Кислая среда
(избыток H+) Написать уравнение в молекулярной форме и расставить степени окисления
+7 +4 +2 +6
KMnO4 + K2SO3 +H2SO4→MnSO4 + K2SO4 + H2O
Полное ионное уравнение:
K+ + MnO4-1 + 2K+ + SO3-2 + 2H+ +SO4-2 →
Mn+2 + SO4-2 +2K+ + SO4-2 + H2O
Подчеркнуты ионы, которые изменили свой внешний вид.
Слайд 27
Записать эти частицы претерпевшие изменения, т.е. незавершенные полуреакции:
MnO4-1
→ Mn+2
SO3-2 → SO4-2
Установим материальный баланс:
MnO4-1+ 8H+ → Mn+2
+ 4H2OSO3-2 + H2O → SO4-2 + 2H+
Составим баланс по разделам:
MnO4-1+ 8H+ → Mn+2 + 4H2O
-1+8 → +2+0
+7 → +2
Прибавим в левую часть пять электронов.
.
Слайд 28
SO3-2 + H2O → SO4-2 + 2H+
-2+0 → -2+2
-2 → 0 Следовательно надо отнять два электрона в левой части.
Составим электронный баланс (число отданных электронов должно быть равно числу принятых электронов)
MnO4-1+ 8H+ + 5ē → Mn+2 + 4H2O 2
SO3-2 + H2O - 2ē → SO4-2 + 2H+ 10 5
Слайд 29
MnO4-1 + 16H+ + 5SO3-2 + 5H2O→
2Mn+2
+ 8H2O + 5SO4-2 + 10H+
Сложим левые и
правые части полуреакций с учетом дополнительных множителей. Сохраним одинаковые частицы в левой и правой части уравнения. 5MnO4-1 + 5SO3-2 + 6H+→2Mn+2 + 5SO4-2 + 3H2O
-2+(-10)+6 → +4+(-10)+0
-6 = -6
Слайд 30 Заряд левой части равен заряду правой части значит
уравнение составлено верно. Полученные коэффициенты переносим в уравнение, написанное
в молекулярной форме:2KMnO4 + 5K2SO3 + 3H2SO4→2MnSO4 + 6K2SO4 + 3H2O
Итак, в кислой среде каждая избыточная частица кислорода взаимодействует с двумя ионами водорода (2H+) с образованием воды, а каждая недостающая частица кислорода (O-2) берется из воды с образованием двух ионов водорода (2H+).
Слайд 31
2) Щелочная среда (избыток OH- и H2o)
+7
+4
+6 +6KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2O
Окислитель восстановитель
MnO4-1 + ē → MnO4-2
SO3-2 +2OH- - 2ē → SO4-2 + H2O
2MnO4-1 + SO3 +2OH- → 2MnO4-2 + SO4-2 + H2O
-2+(-2)+(-2) → 2*(-2)+(-2)+0
-6 = -6 - проверка.
Переносим коэффициенты в молекулярное уравнение:
2KMnO4 + K2SO3 + KOH → 2K2MnO4 + K2SO4 + H2O
Слайд 32 Итак, в щелочной среде каждая недостающая частица кислорода
(O-2) берется их двух гидроксильных групп с образованием молекул
воды, а каждая избыточная частица кислорода связывается с молекулой воды с образованием двух гидроксильных групп (2OH-).Каждая избыточная частица водорода (H+) связывается с гидроксильной группой с образованием молекул воды.
Слайд 33
3) Нейтральная среда (HOH)
В нейтральной среде каждая избыточная
частица кислорода взаимодействует с молекулой воды с образованием двух
гидроксильных групп (2OH-). Недостающая частица кислорода берется из воды с образованием двух ионов водорода (2H+).Пример: KMnO4 + K2SO3 + H2O → MnO2↓ + K2SO4 + …
MnO4-1 → MnO20
SO3-2 → SO4-2
MnO4-1 + 2H2O + 3ē → MnO20 + 4OH-
SO3-2 + H2O - 2ē → SO4-2 + 2H+
Слайд 34
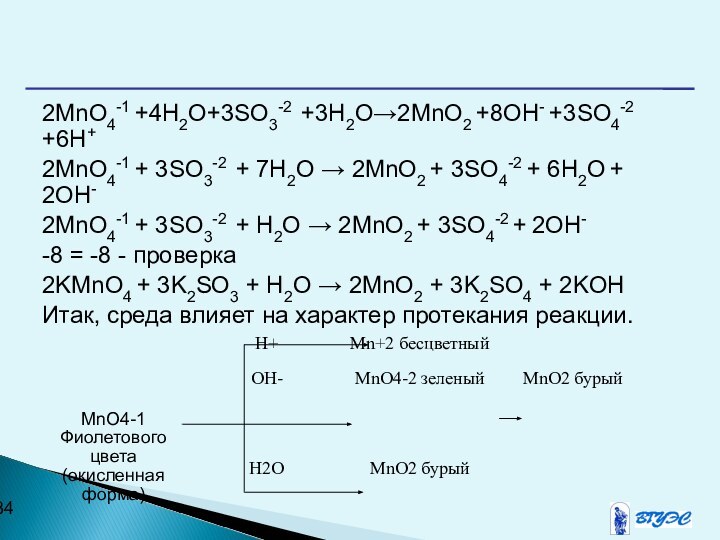
2MnO4-1 +4H2O+3SO3-2 +3H2O→2MnO2 +8OH- +3SO4-2 +6H+
2MnO4-1 + 3SO3-2
+ 7H2O → 2MnO2 + 3SO4-2 + 6H2O +
2OH-2MnO4-1 + 3SO3-2 + H2O → 2MnO2 + 3SO4-2 + 2OH-
-8 = -8 - проверка
2KMnO4 + 3K2SO3 + H2O → 2MnO2 + 3K2SO4 + 2KOH
Итак, среда влияет на характер протекания реакции.
Слайд 35 +7 -2
+4
+6KMnO4 → MnO2 + K2MnO4 + O20
В одном и том же веществе находятся и окислитель и восстановитель, но эти функции выполняют разные атомы.
Уравняем реакцию методом электронного баланса, так как это реакция разложения кристаллического вещества:
Mn+7 + 3ē → Mn+4
Mn+7 + 1ē → Mn+6
2O-2 - 4ē → O20
Слайд 36
2Mn+7 + 4ē → Mn+4 + Mn+6
2O-2
- 4ē → O20
2Mn+7 + 2O-2 → Mn+4 +
Mn+6 + O20+10 = +10 – проверка
2KMnO4 → MnO2 + K2MnO4 + O20
Слайд 37 В одном и том же веществе окислитель и
восстановитель, но эти функции несут одинаковые атомы с одинаковыми
зарядами.Пример: CL20 + H2O → HCL-1 + HCLO
Реакции идут в растворе, уравняем методом полуреакций:
CL0 →CL-1
CL0 → CLO-1
CL0 + ē → CL-1
CL20 + H2O - ē → CLO-1 + 2H+
CL20 + H2O → CL-1 + CLO-1 + 2H+
0 = 0
Конечное уравнение:
CL2 + H2O = HCL + HCLO
Слайд 38
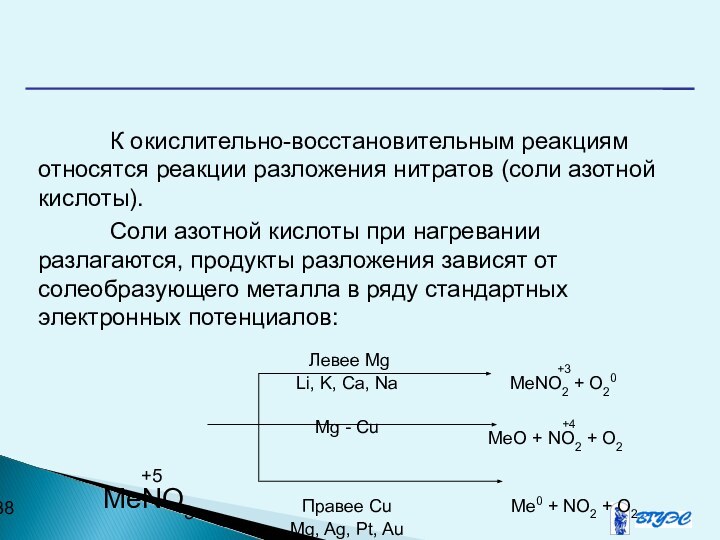
К окислительно-восстановительным реакциям относятся реакции разложения нитратов (соли
азотной кислоты).
Соли азотной кислоты при нагревании разлагаются, продукты разложения
зависят от солеобразующего металла в ряду стандартных электронных потенциалов:
Слайд 39
Пример: Разложение нитрата кальция
+5 -2
+3Ca(NO3)2 → Ca(NO2)2 + O20
N+5 + 2ē → N+3
2O-2 - 4ē→ O2
2N+5 + 2O-2 → 2N+3 + O2
+6 = +6 – проверка
Конечное уравнение:
Ca(NO3)2 → Ca(NO2)2 + O2
Разложение нитрата цинка:
Zn(NO3)2 → ZnO + N+4O2 + O20
N+5 + ē →N+4
2O-2 - 4ē → O20
4N+5 + 2O-2 → 4N+4 + O20
+16 = +16 – проверка
Слайд 40
Разложение нитрата серебра:
+1 +5 -2
+4
AgNO3 → Ag0 + NO2 + O20
Ag+1 + ē → Ag0
N+5 + ē → N+4
2O-2 + 4ē → O2
Ag+1 + N+5 + 2ē → Ag0 + N+4
2O-2 + 4ē → O2
2Ag+1 + 2N+5 + 2O-2 → 2Ag0 + 2N+4 + O2
+8 = +8 – проверка
Разложение при нагревании (термолиз) – важное свойство солей азотной кислоты.