Химическая связь.
Под химической связью
понимают такое взаимодействие атомов, которое связывает их в
молекулы, ионы, радикалы,
кристаллы.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




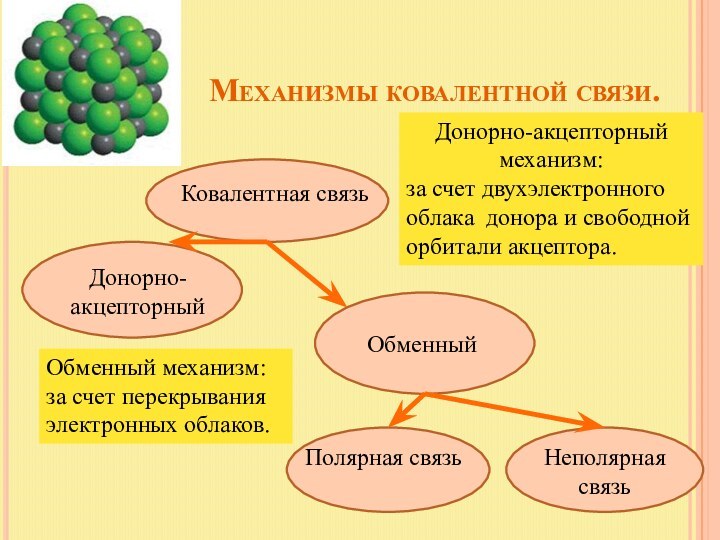
















Донорно-акцепторный механизм:
за счет двухэлектронного облака донора и свободной орбитали акцептора.
неполярная ковалентная связь – электронное облако, образованное общей парой электронов, распределяется в пространстве
Н:Cl
HCl; H2O; H2S
полярная ковалентная связь – электронное облако связи смещено к атому с большей электроотрицательностью
Связь называется донорно-акцепторной или координационной.
Энергия связи – количество энергии, которое необходимо для разрыва связи; (кДж/моль).
Насыщенность – способность атомов образовывать ограниченное число ковалентных связей.
Направленность связи обусловливает пространственную структуру молекул, т.е. их геометрию.
S-S
S - P
P - P
P - P
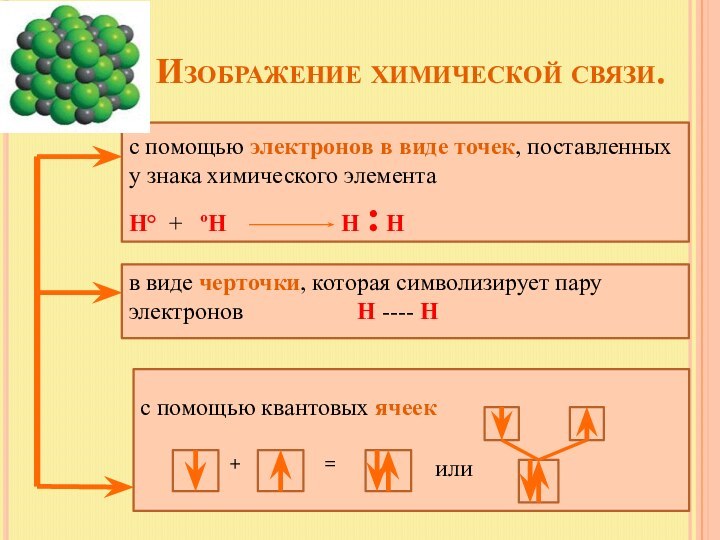
в виде черточки, которая символизирует пару электронов Н ---- Н
с помощью квантовых ячеек
+
=
или
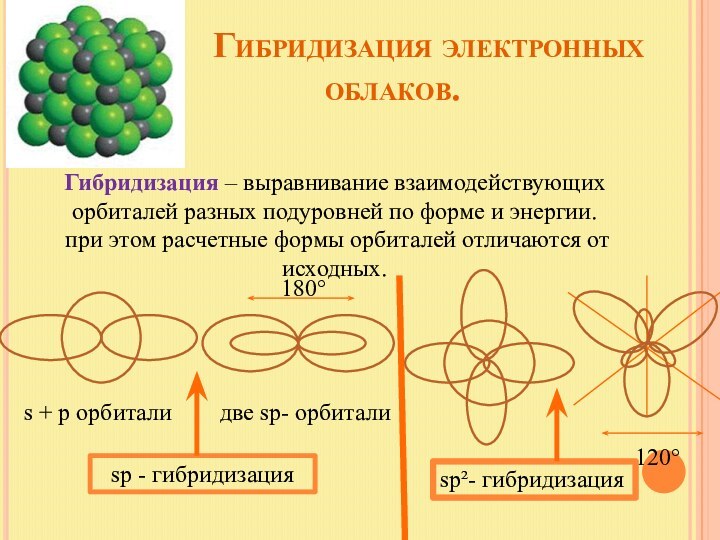
s + p орбитали две sp- орбитали
sp - гибридизация
180°
120°
sp²- гибридизация
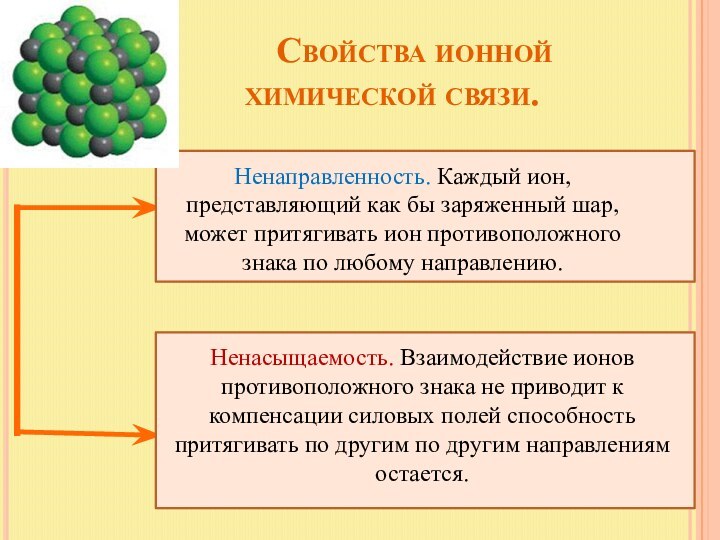
Ненасыщаемость. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей способность притягивать по другим по другим направлениям остается.
μ = q · Ɩ электрический момент диполя. Мера полярности связи и молекулы. Выражается в Кл·м (Кулон-метр).
Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке – называется металлической.
1. Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей.
Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме.
Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального.
Металлическая связь характерна для металлов твердом и жидком состоянии.
Связь между атомом водорода , соединенным с атомом сильно электроотрицательного элемента, одной молекулы и сильно электроотрицательными элементами другой молекулы – называется водородной.
Связь относится к межмолекулярной; возможно образование внутримолекулярной водородной связи.
Водородная связь вторая по образованию в веществе, поэтому более слабая.
Тем не менее она ответственна за ассоциацию молекул.
Водородная связь оказывает влияние на
свойства вещества, т.к. нужна
дополнительная энергия для разрыва
водородной связи.