- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Процесс электролитической диссоциации
Содержание
- 2. Электролитическая диссоциация
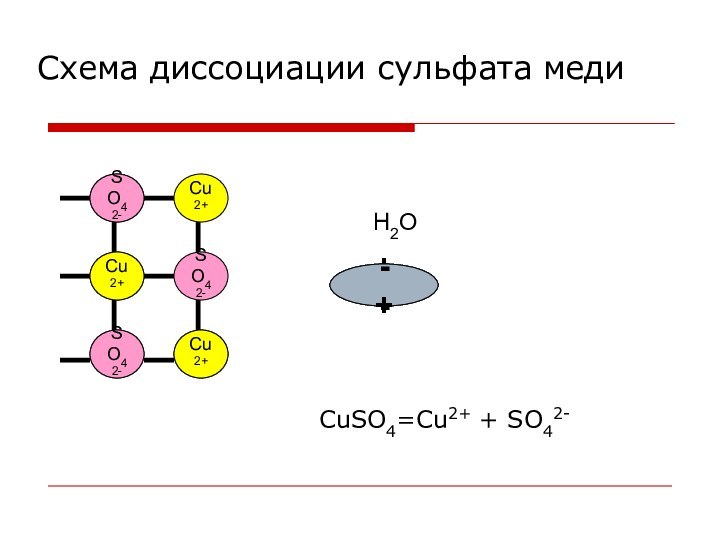
- 3. Cu2+SO42-Cu2+Cu2+Cu2+SO42-SO42-+ -H2O- +- +Схема диссоциации сульфата медиCuSO4=Cu2+ + SO42-
- 4. Схема электролиза сульфата медиCuSO4 ↔ Cu2+
- 5. Выводы:При растворении электролитов под влиянием электрического поля
- 6. Масса вещества, выделившегося на электроде за время
- 7. Майкл Фарадей(1711 -1867)
- 8. Задача. При никелировании детали в течении
- 9. Применение электролизаI Химическая промышленность: Получение галогенов,
- 10. ЗаключениеЭлектрический ток в жидкостях создается движением ионов.Причина
- 11. Скачать презентацию
- 12. Похожие презентации
Электролитическая диссоциация










Слайд 4
Схема электролиза сульфата меди
CuSO4 ↔ Cu2+ +SO42−
K(-): Cu2+ + 2e = Cu0
A(+):
4OH− — 4e = 2H2O + O2Вывод:
CuSO4 (электролиз) → Cu + 2H2O + O2
Слайд 5
Выводы:
При растворении электролитов под влиянием электрического поля полярных
молекул воды происходит распад молекул электролитов на ионы -этот
процесс называется электролитической диссоциацией.Процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, называют электролизом.
При тепловом (хаотическом) движении может происходить обратный процесс – рекомбинация – ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы. В растворе электролита наряду с ионами находятся и молекулы.
Слайд 6
Масса вещества, выделившегося на электроде за время
t при прохождении электрического тока, пропорциональна силе тока и
времени.
Слайд 8
Задача.
При никелировании детали в течении 50
минут сила тока, проходящего через ванну, была равна 2А.
Какова масса, выделившегося вещества на детали, если электрохимический эквивалент никеля к=3·10-7 кг/Кл?
Слайд 9
Применение электролиза
I Химическая промышленность:
Получение галогенов, водорода,
щелочей.
II Металлургия:
Получение активных металлов, очистка металлов от
примесейIII Защита от коррозии:
Электролитическим путем покрывают поверхность одного металла тонким слоем другого.
IV Очистка сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Слайд 10
Заключение
Электрический ток в жидкостях создается движением ионов.
Причина их
появления – диссоциация.
Электролиз – сложный физико-химический процесс, происходящий не
только внутри жидкости, но и на электродах.При создании определенных условий можно получить целевой продукт с заранее заданными свойствами и качествами.