Слайд 2
Общая характеристика II побочной подгруппы
* Электронное строение
+30Zn 1s2
2s2 2p6 3s2 3p6 3d10 4s2
+48Cd . . .
4d10 5s2
+80Hg . . . 5d10 6s2
* Степень окисления
Zn +2
Cd +2, +1
Hg +2, +1
Сверху вниз уменьшаются металлические свойства, основные свойства их гидроксидов
Слайд 3
Нахождение в природе
В земной коре цинк находится
в виде смеси шести стабильных изотопов.
Первое
место в мире по добыче (16,5% мировой добычи, 1113 тыс. т ) и запасам цинка занимает Канада. Кроме того, богатые месторождения цинка сосредоточены в Китае (13,5%), Австралии (13%), Перу (10%), США (10%), Ирландии (около 3%).
Добыча цинка ведется в 50 странах. В России цинк извлекается из медноколчеданных месторождений Урала, а также из полиметаллических месторождений в горах Южной Сибири и Приморья. Крупные запасы цинка сосредоточены в Рудном Алтае (Восточный Казахстан), на долю которого приходится более 50% добычи цинка в странах СНГ. Цинк добывают также в Азербайджане, Узбекистане (месторождение Алмалык) и Таджикистане.
Слайд 4
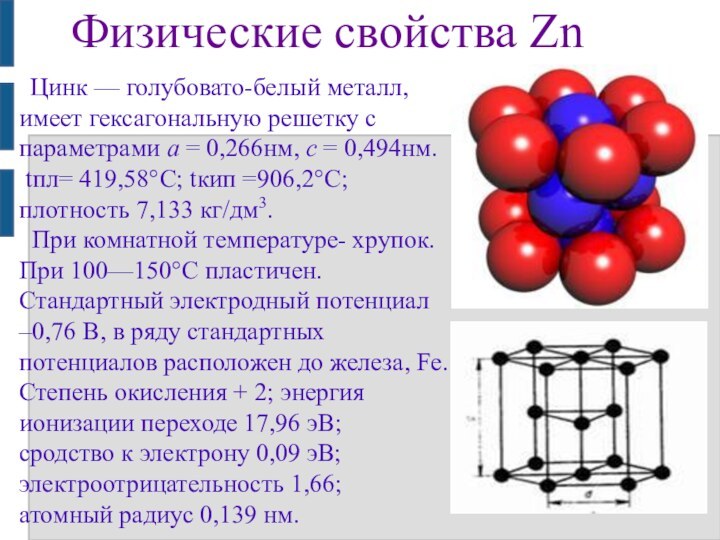
Физические свойства Zn
Цинк — голубовато-белый металл, имеет
гексагональную решетку с параметрами а = 0,266нм, с =
0,494нм.
tпл= 419,58°C; tкип =906,2°C; плотность 7,133 кг/дм3.
При комнатной температуре- хрупок. При 100—150°C пластичен. Стандартный электродный потенциал –0,76 В, в ряду стандартных потенциалов расположен до железа, Fe.
Степень окисления + 2; энергия ионизации переходе 17,96 эВ;
сродство к электрону 0,09 эВ; электроотрицательность 1,66;
атомный радиус 0,139 нм.
Слайд 5
Химические свойства Zn
На воздухе цинк покрывается тонкой пленкой
оксида ZnO. При сильном нагревании сгорает с образованием амфотерного
белого оксида ZnO:
2Zn + O2 = 2ZnO
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так и щелочами:
ZnO + 2NaOH (сплавление)= Na2ZnO2 + Н2О
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
и растворами щелочей:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
Слайд 6
При нагревании цинк реагирует с галогенами с образованием
галогенидов. С фосфором цинк образует фосфиды Zn3P2 и ZnP2.
Нитрид Zn3N2получают реакцией цинка с аммиаком NH3 при 550—600°C. С серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Слайд 7
Наиболее распространенный минерал цинка —
сфалерит, или цинковая
обманка. Основной
компонент минерала — сульфид цинка, ZnS, а
разнообразные примеси
придают этому веществу
всевозможные цвета, за это минерал называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30.
Свойства сфалерита- жёлтый, красновато-оранжевый, зеленовато-жёлтый, серый, тёмно-серый, почти бесцветный; блеск алмазный; неровный, хрупкий; плотность - 4,08 - 4,10 г/см³.
Важнейшие соединения
Кристалл сфалерита
Огранённый сфалерит из Испании
Слайд 8
Смитсонит или цинковый шпат
Формула - ZnCO3
Цвет - светло-зелёный,голубой,
розовый; перламутровый блеск, неровный, хрупкий, плотность - 3 -
4,5 г/см³
Аурихальцит
Формула — (ZnCu)5(CO3)2(OH)6
Цвет - бледнозелёный до зеленовато-синего и небесно-голубого;
блеск - шелковистый до перламутрового;
плотность - 3,64 г/см³
Слайд 9
Гемиморфит или каламин
Формула - Zn4[Si2O7] (OH)2 x H2O
Цвет
- голубой, розовый, зеленый, бесцветный; стеклянный блеск; хрупок; плотность
- 3,4 - 3,5 г/см³
Цинкит
Формула — ZnO, имеет примеси MgO, PbO, FeO.
Цвет - красный, оранжевый, буровато-красный; блеск алмазный, хрупок; плотность - 5,4 - 5,7 г/см³
Виллемит
Формула — Zn2[SiO4], имеет примеси Са, Fe, Mg,Mn.
Цвет - жёлтый, зеленоватый, красно-коричневый;
блеск смолоподобный, хрупок, неровный, плотность 3,89 — 4,18 г/см³.
Слайд 10
Получение
Цинк добывают из полиметаллических руд, в виде
сульфида, который обжигают:
2ZnS+ 3O2= 2ZnO+ 2SO2
а) Пирометаллургический метод
ZnO + C = Zn + CO (1200—1300°C)
б) Гидрометаллургический метод.
ZnO + H2SO4= ZnSO4 + H2O Из полученного сульфатного раствора удаляют примеси, осаждая их цинковой пылью. Очищенный раствор подвергают электролизу. Цинк осаждается на алюминиевых катодах. Чистота электролитного цинка 99,95%.
Для получения цинка высокой чистоты применяют зонную плавку.
Слайд 11
* Цинковые покрытия используются для защиты стали от
коррозии;
*Сплавы меди с цинком применяются в технике;
*Многие соединения цинка
являются люминофорами, например, три основных цвета на экране кинескопа зависят от ZnS·Ag (синий цвет), ZnSe·Ag (зеленый цвет) и Zn3(PO4)2·Mn (красный цвет);
*Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, т. е. в батарейках и аккумуляторах, в аккумуляторах для компьютеров (ноутбуки), в цинк-воздушных аккумуляторах;
*интенсивно разрабатываются аккумуляторы на основе системы цинк-воздух — для пуска двигателей (220—300 Вт/час/кг) и для электромобилей (пробег до 900 км).
П р и м е н е н и е
Слайд 12
Нахождение в природе
Кадмий относится к редким, рассеянным
элементам: он
содержится в виде изоморфной
примеси во многих минералах и всегда
в
минералах цинка. Известно всего лишь 6
редких кадмиевых минералов, например,
хоулиит, ксантохроит CdS(H2O)х (77,2 % Cd) кадмоселит CdSe (47 % Cd), гринокит GdS, отавит CdCO3 , монтепонит CdO.
Кадмий накапливается в полиметаллических рудах: сфалерите (0,01-5%), галените (0,02%), халькопирите (0,12%), пирите (0,02%), блеклых рудах и станнине (до 0,2%).Кадмий способен накапливаться в растениях (больше всего в грибах) и живых организмах (особенно в водных), по этой причине кадмий можно обнаружить в морских осадочных породах — сланцах (Мансфельд, Германия). Общие мировые ресурсы кадмия оцениваются в 20 млн тонн, промышленные — в 600 тыс. тонн.
Слайд 13
Физические свойства
Кадмий — серебристо-белый мягкий металл с
гексагональной решеткой (а = 0,2979, с = 0,5618 нм).
tпл= 321,1 °C, tкип= 766,5 °C, плотность 8,65 кг/дм3. Ковкий и тягучий — он отлично прокатывается
в листы и протягивается в проволоку, без особых проблем поддается полировке.
При нагреве выше 80 °C кадмий теряет свою упругость, причем настолько, что его легко можно истолочь в порошок. Если кадмиевую палочку изгибать, то можно услышать слабый треск — это трутся друг о друга микрокристаллики металла,
однако любые примеси в металле уничтожают
этот эффект. Стандартный электродный
потенциал кадмия —0,403 В, в ряду
стандартных потенциалов он расположен
до водорода. В сухой атмосфере кадмий устойчив, во влажной постепенно покрывается пленкой оксида CdO.
Слайд 14
Химические свойства
Выше температуры плавления кадмий горит
на воздухе с
образованием оксида CdO бурого
цвета:
2Сd + O2 = 2CdO
Пары кадмия реагируют с парами воды с
образованием водорода:
Cd + H2O = CdO + H2
По сравнению со своим соседом по группе IIB
— Zn кадмий медленнее реагирует с кислотами:
Сd + 2HCl = CdCl2 + H2
Легче всего реакция протекает с азотной кислотой:
3Cd + 8HNO3 = 3Cd(NO3)2 + 2NO + 4H2O
С щелочами кадмий не реагирует.
В реакциях может выступать в качестве мягкого восстановителя, например в концентрированных растворах он способен восстанавливать нитрат аммония до нитрита NH4NO2:
NH4NO3 + Cd = NH4NO2 + CdO
Кадмий окисляется растворами солей Cu (II) или Fe (III):
Cd + CuCl2 = Cu + CdCl2;
2FeCl3 + Cd = 2FeCl2 + CdCl2
Слайд 15
Выше температуры плавления кадмий реагирует с галогенами с
образованием галогенидов:
Cd + Cl2 = CdCl2
С серой
и другими халькогенами образует халькогениды:
Cd + S = CdS
С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует. Нитрид Cd3N2 и гидрид CdH2 получают косвенными путями.
В водных растворах ионы кадмия Cd2+ образуют аквакомплексы [Cd(H2O)4]2+ и [Cd(H2O)6]2+.
Гидроксид кадмия Cd(OH)2 получают добавлением к раствору соли кадмия щелочи:
СdSO4 + 2NaOH = Na2SO4 + Cd(OH)2
Гидроксид кадмия в щелочах практически не растворяется, хотя при длительном кипячении в очень концентрированных растворах щелочей зафиксировано образование гидроксидных комплексов [Cd(OH)6]2–. Таким образом, амфотерные свойства оксида CdO и гидроксида Cd(OH)2 кадмия выражены гораздо слабее, чем у соответствующих соединений цинка.
Гидроксид кадмия Cd(OH)2 за счет комплексообразования легко растворяется в водных растворах аммиака NH3:
Cd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2
Слайд 16
Важнейшие соединения
Цвет- от бесцветного, белого до желто- коричневого
и красноватого; блеск- стеклянный до алмазного; плотность- 4,96 г/см³.
Цвет-
канареечно-
жёлтый, оранжево-
жёлтый, тёмно-
оранжевый переходящий в
красный; полупрозрачный; блеск алмазный, иногда смоляной; хрупкий;
плотность - 4.8 - 4.9 г/см³.
Гринокит GdS
Слайд 17
Пирит или
железный колчедан
Халькопирит или медный колчедан
Галенит
Цвет- светлый латунно-
и золотисто-желтый; плотность- 4900-5200 кг/м3. На поверхности Земли пирит
неустойчив, легко окисляется кислородом воздуха и грунтовыми водам; блеск сильный, металлический; присутствует в изверженных породах.
Цвет халькопирита зеленовато- или латунно-желтый; мягкий, легко царапается ножом; плотность 4,3 г/см³; блеск металлический. В качестве примесей в минерале присутствуют благородные металлы.
Цвет свинцово-серый; блеск металлический, минерал сравнительно мягкий; плотность — 7,5 г/см³
е
Основные источники кадмия — промежуточные продукты цинкового производства, пыль
свинцовых и медеплавильных заводов. Сырье обрабатывают концентрированной серной кислотой и получают СdSO4 в растворе. Из раствора Cd выделяют, используя цинковую пыль:
CdSO4 + Zn = ZnSO4 + Cd
Полученный металл очищают переплавкой под слоем щелочи для удаления примесей цинка и свинца. Кадмий высокой чистоты получают электрохимическим рафинированием с промежуточной очисткой электролита или методом зонной плавки.
Чистый кадмий
Гранулированный кадмий
и е
- 40% производимого кадмия используется для нанесения антикоррозионных
покрытий на металлы.
- 20% кадмия идет на изготовление кадмиевых электродов, применяемых в аккумуляторах, нормальных элементах Вестона. Кадмиевое покрытие надежно предохраняет железные и стальные изделия от атмосферной коррозии.
- Порядка 20 % кадмия (в виде соединений) используется для производства неорганических красящих веществ. Сульфид кадмия CdS — важный минеральный краситель, ранее называвшийся кадмиевой желтью.
Нормальный элемент Вестона
Изделие из стали
CdS
Слайд 20
Нахождение в природе
Ртуть — довольно редкий элемент
в Земной
коре, но её содержание почти в семнадцать раз
больше,
чем золота или платины. Основная
форма нахождения ртути в природе —
рассеянная и только 0,02 % её заключено в
месторождениях. Важнейшим минералом
является — киноварь HgS с содержанием ртути 86 %.
К второстепенным рудным минералам можно отнести метациннабарит (β-сульфид ртути), самородную ртуть (в виде мельчайших капелек), ливингстонит (HgSb4S7), кордероит (Hg3S2Cl2), тиманит (HgSe), колорадоит (HgTe) и блеклые ртутьсодержащие руды. Всего в мире обнаружено более пяти тысяч ртутных месторождений, рудных участков и рудопроявлений, получивших самостоятельное название.
Слайд 21
Физические свойства
Ртуть — серебристо-белый металл, в парах
бесцветный. Единственный жидкий при комнатной температуре металл.
tпл = 38,87°C,
tкип=356,58°C. Плотность жидкой ртути при 20°C = 13,5457 г/см3 , твердой ртути при -38,9°C = 14,193 г/см3. Твердая ртуть — бесцветные кристаллы октаэдрической формы, существующая в двух кристаллических модификациях: «высокотемпературная» модификация и «низкотемпературная модификация». Жидкая ртуть не смачивает стекло и практически не растворяется в воде.
Слайд 22
Химические свойства
Ртуть окисляется кислородом воздуха при температуре выше
300°C, образуя оксид ртути HgO красного цвета:
2Hg +
O2 = 2HgO
Ртуть не взаимодействует с азотом, фосфором, мышьяком, углеродом, кремнием, бором, германием.
С разбавленными кислотами (кроме азотной) ртуть не реагирует, но растворяется в царской водке и в азотной кислоте. Причем, в случае с кислотой продукт реакции зависит от концентрации кислоты и соотношения ртути и кислоты. При избытке ртути, на холоду, протекает реакция:
6Hg + 8HNO3 разбавл. = 3Hg2(NO3)2 + 2NO + 4H2O
При избытке кислоты:
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO + 4H2O
С галогенами ртуть активно взаимодействует с образованием галогенидов. При реакциях ртути с серой, селеном и теллуром возникают халькогениды- HgS, HgSe, HgTe. Эти халькогениды практически не растворимы в воде.
Слайд 23
Красная модификация образуется при добавлении к раствору соли
Hg2+ щелочи:
Hg(NO3)2 + 2NaOH = HgO + 2NaNO3
+ H2O
При добавлении щелочи к раствору соли ртути(I) образуется оксид
ртути (I) Hg2O:
Hg2(NO3)2 + 2NaOH = Hg2O + H2O + 2NaNO3
Для соединений ртути(II) характерно образование устойчивых комплексных соединений:
2KI + HgI2 = K2[HgI4],
2KCN + Hg(CN)2 = K2[Hg(CN)4]
Получают эти соединения, восстанавливая соли ртути(II) ртутью:
HgSO4 + Hg + 2NaCl = Hg2Cl2 + Na2SO4,
HgCl2 + Hg = Hg2Cl2
В зависимости от условий, соединения ртути(I) могут проявлять как окислительные, так и восстановительные свойства:
Hg2Cl2 + Cl2 = 2HgCl2,
Hg2Cl2 + SnCl2 = 2Hg + SnCl4
Слайд 25
КИНОВАРЬ- HgS — минерал. Самый распространённый ртутный минерал.
Имеет алую окраску, на свежем сколе напоминает пятна крови.
На воздухе постепенно окисляется с поверхности, покрываясь тонкой плёнкой; плотность 8,09-8,20 г/см³. Легко плавится, при нагревании на воздухе до 200 °C полностью улетучивается с образованием паров ртути и сернистого газа. Растворима только в царской водке.
МЕТАЦИННАБАРИТ — β-HgS- цвет чёрный, серовато-чёрный, коричнево-чёрный; блеск металлический; непрозрачен; разлагается в царской водке и хлором.
САМОРОДНАЯ РТУТЬ- минерал, природная металлическая ртуть. Иногда содержит примесь серебра и золота.
Слайд 26
Ливингстонит- HgSb4S7
Кордероит- Hg3S2Cl2
Колорадоит- HgTe
е
Первоначально ртуть получали из киновари, помещая ее куски
в вязанки хвороста и обжигая киноварь в кострах.
В настоящее время ртуть получают
окислительно-восстановительным обжигом
руд или концентратов при 700—800оС в печах кипящего слоя, трубчатых или муфельных.
Условно процесс может быть выражен:
HgS + O2 = Hg + SO2
Выход ртути при таком способе составляет
около 80%. Более эффективен способ
получения ртути путем нагревания руды с Fe
и CaO:
HgS + Fe = Hg + FeS,
4HgS + 4CaO = 4Hg + 3CaS + CaSO4
и е
- для изготовления катодов.
- при нанесении золотых покрытий
и при добычи золота из руды.
- HgS применяют для лечения глазных и кожных и венерических заболеваний, также используют для приготовления чернил и красок. В древности из киновари готовили румяна. Каломель используется в ветеринарии в качестве слабительного средства.
Слайд 29
* ртуть используется в производстве термометров, барометров и
др. измерительных приборах;
* парами ртути заполняют лампы дневного света;
*
в органичесхих соединениях- как катализатор.
Слайд 30
Ртуть и ее соединения высокотоксичны. Пары и соединения
ртути накапливаясь в организме человека, сорбируются легкими, попадают в
кровь, нарушают обмен веществ и поражают нервную систему. Признаки ртутного отравления проявляются уже при содержании ртути в концентрации 0.0002–0.0003 мг/л. Пары ртути фитотоксичны, ускоряют старение растений.
При работе с ртутью и ее соединениями следует предотвращать ее попадание в организм через дыхательные пути и кожу. Хранят в закрытых сосудах.
Пары кадмия и его соединения токсичны, причем кадмий может накапливаться в организме. В питьевой воде ПДК для кадмия 10 мг/м3. Симптомы острого отравления солями кадмия — рвота и судороги. Растворимые соединения кадмия после всасывания в кровь поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Это должен знать каждый !







![Металлы II, побочной подгруппы ПСХЭ Гемиморфит или каламинФормула - Zn4[Si2O7] (OH)2 x H2OЦвет - голубой, розовый, зеленый,](/img/tmb/15/1469005/40725684fedc864b3c46223ba62ebf32-720x.jpg)





















