dγ- и dε- орбиталями небольшая, возможен переход электрона с
более низкого на более высокий уровень энергии за счет поглощения видимого света. Этот переход является причиной определенной окраски комплекса, т. е. окраска зависит от того, фотоны какой длины волны могут этим комплексом поглощаться.
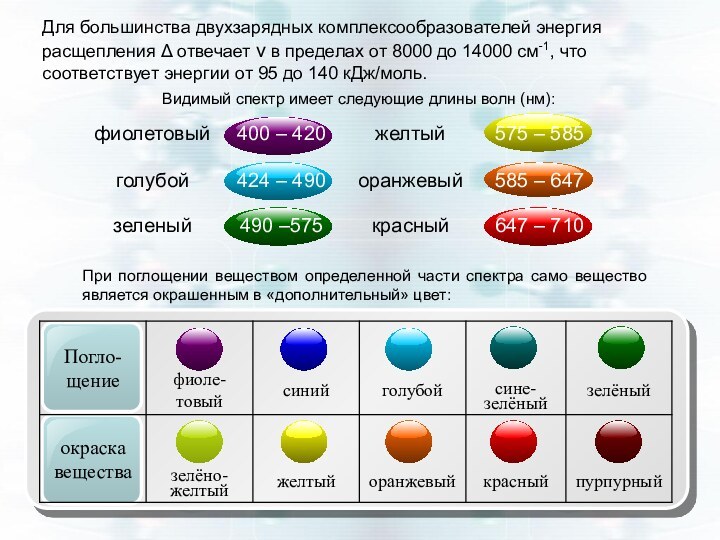
При этом энергия кванта света должна быть точно равна энергии расщепления Δ, т. е. h ⋅ ν = Δ. Зная длину волны света (λ = c / ν), соответствующую окраске комплекса, можно рассчитать для того или иного лиганда Δ = ch / λ.
При замене в комплексе одних лигандов на другие, расположенные в спектрохими-ческом ряду левее (т. е. обладающие большей силой поля), значение Δ возрастает, и комплекс начинает поглощать лучи света с меньшей длиной волны. Это сказы-вается на изменении его окраски. Например,
















![Химическая связь Координационное число: количество лигандов, располагающихся вокруг комплексообразователя [Аg(NH3)2]+ [Al(OH)6]3–Аg+, Аl3+ – комплексообразователи;NН3,](/img/tmb/15/1415330/1c3e9dba75799c505fd5ce51fa055caf-720x.jpg)
![Химическая связь [Zn(CN)4]?Z = Z Zn+2 + 4ZCN– = 2+4(-1) = -2 ⇒ [](/img/tmb/15/1415330/ded7466413d47bae59db5745dbd09fef-720x.jpg)

![Химическая связь Комплекс [AlBr4]–Атом Аl …3s23р1 комплексообразователь Al3+: неподеленная пара электронов лигандов](/img/tmb/15/1415330/3edbe4904b46be27a25721b49ac7f5e5-720x.jpg)
![Химическая связь Комплекс Fe(CN)6]3-Комплексообразователь Fe3+: 3d54s0.Лиганды CN– – лиганды сильного поля,:CN–:CN–:CN–:CN–:CN–:CN–Fe+33d](/img/tmb/15/1415330/174d9ada1788c1b6dc01fa12e51440c0-720x.jpg)




![Химическая связь Комплекс [Co(Н2О)6]2+.Комплексообразователь Со2+: 3d74s0.К.ч. 6 ⇒ октаэдрическое расщепление. центральный атом – 3d](/img/tmb/15/1415330/8f6b77a1ebdb026f787c737d5185baa3-720x.jpg)
![Химическая связь sp3d2-гибридизация структура комплекса [Со(Н2О)6]2+ – октаэдрКомплекс – высокоспиновый, внешнеорбитальный, т. к.](/img/tmb/15/1415330/c8e96786afa330ef9383c4518cf9177b-720x.jpg)
![Химическая связь Комплекс [PtВr6]2-комплексообразователь Pt4+: 5d66s0Комплексообразователь 5d- элемент ⇒ лиганды сильного](/img/tmb/15/1415330/08cddf846e8c5a61e518b68da25a5d32-720x.jpg)

![Химическая связь Комплекс [NiCl4]2-комплексообразователь Ni2+: 3d84s2 координационное число – 4 комплексообразователь – 3d- элементалиганды](/img/tmb/15/1415330/8fb98a111f838987acc67c99f1f1ad45-720x.jpg)

![Химическая связь [Cu(H2O)6]2+[Cu(NH3)4(H2O)2]2+Окраска комплексов](/img/tmb/15/1415330/e624c7a338fd6acde9012133eb587801-720x.jpg)
![Химическая связь РЕАКЦИОННАЯ СПОСОБНОСТЬ. [Fe(NH3)6]2+ – внешняя гибридизация (sp3d2) более реакционноспособен, чем [Fe(CN)6)]4-](/img/tmb/15/1415330/355f66283240a5af60b9d241ae35daeb-720x.jpg)
![Химическая связь Реакционная способность комплекса [V(NH3)6]3+ выше, чем у [Cr(NH3)6]3+ из-за наличия свободной «внутренней»](/img/tmb/15/1415330/2a09bd59018d68cec1e494ee53775019-720x.jpg)





























