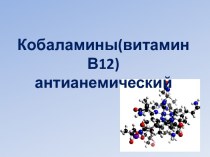
тем, что сера имеет большую емкость электронной оболочки, а
вместе с тем и большую способность к деформации, другими словами, атомы серы в сульфидах легко поляризуются. При этом с ростом поляризующего действия катиона интенсивность окраски возрастает. Сульфиды щелочных металлов бесцветны, потому что они обладают слабым поляризующим действием. В подгруппах Периодической системы наблюдается рост поляризующего действия при движении сверху вниз.AS2S3 желтый ZnS белый Ca2S3 желтый
Sb2S3 оранжевый CdS желтый In2S3 желтый
Bi2S3 черный HgS черный Tl2S3 черный
CeS2 белый MnS – телесного цвета
SnS2 желтый CuS, NiS - черный
PbS черный