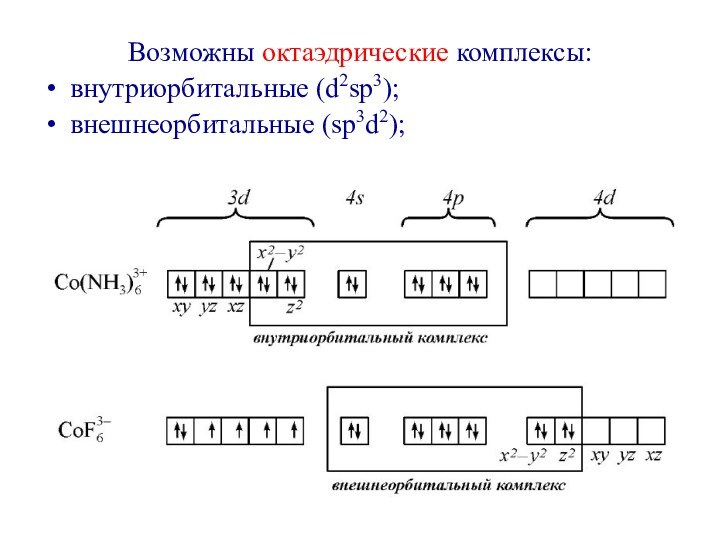
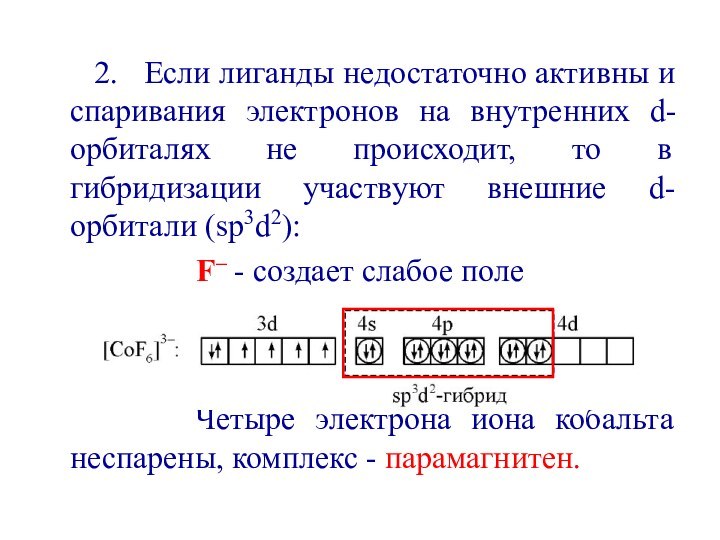
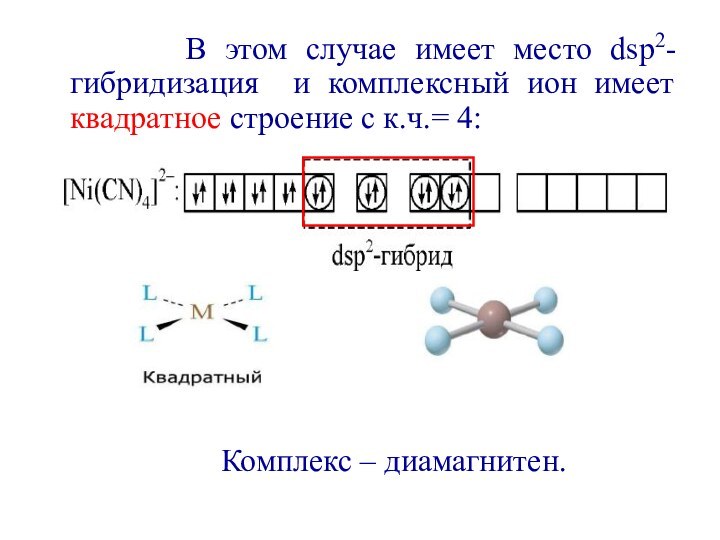
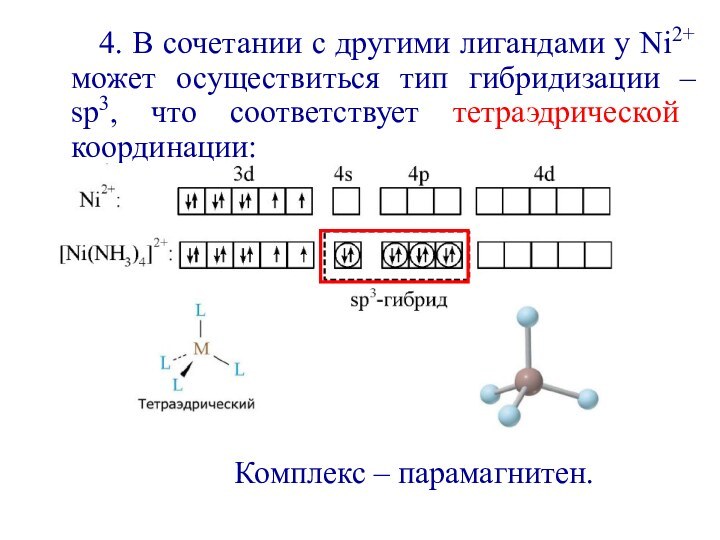
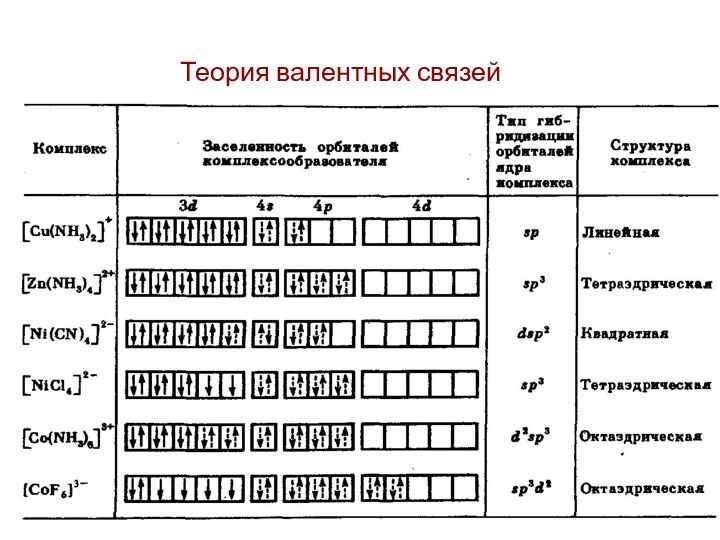
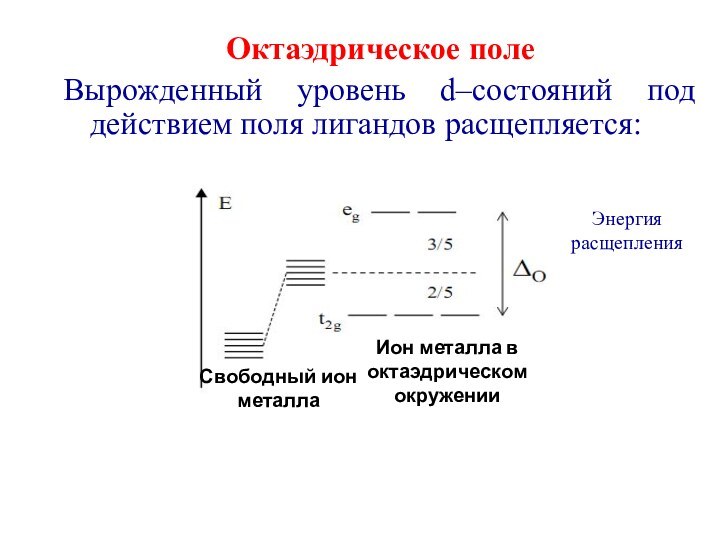
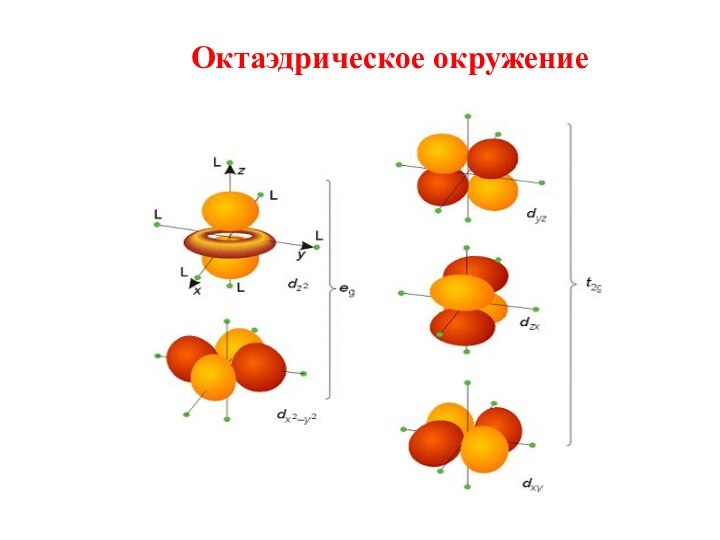
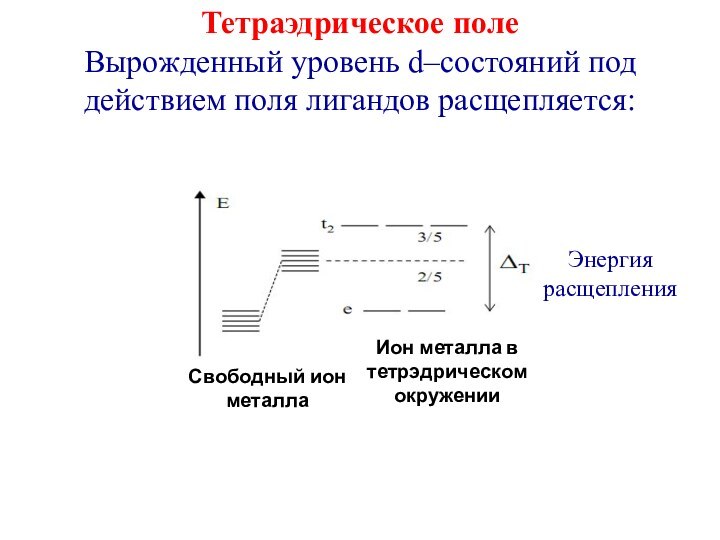
первым попытался объяснить химическую связь в комплексных соединениях.
1893 г. – статья Вернера «О строении неорганических соединений».1913 г. – присуждение Вернеру Нобелевской премии.
Дальнейшее развитие химии КС связано с именем Чугаева. Созданная им школа объединила русских ученых Черняева, Гринберга, их учеников Яцимирского, Кукушкина.