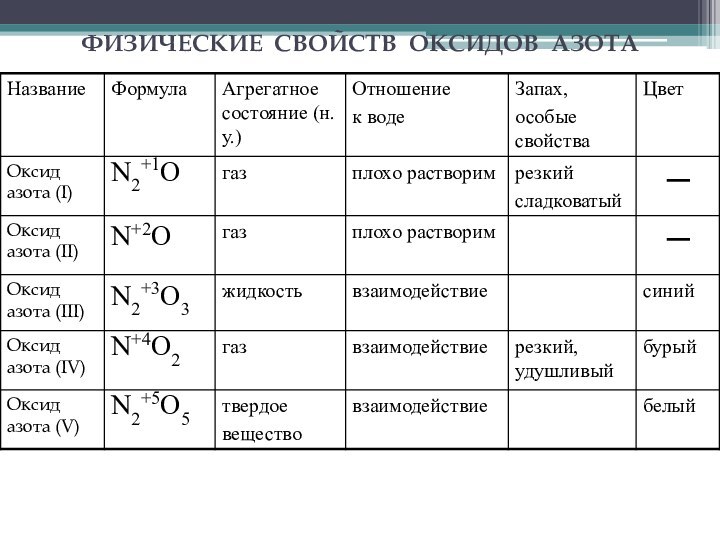
запах сладковатый,
растворим в воде,
анестезирующее средство, не вызывает
раздражения дыхательных путеймалые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость
получение:
1. Разложение нитрата аммония
t°С
NH4NO3 → N2O + 2Н2O