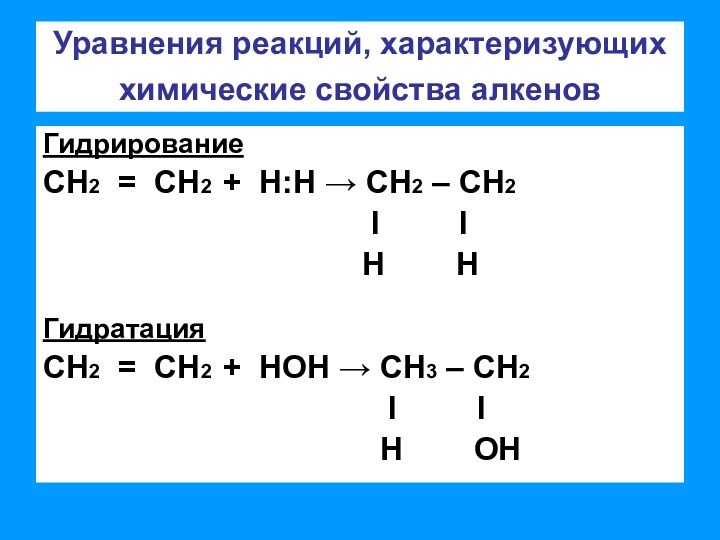
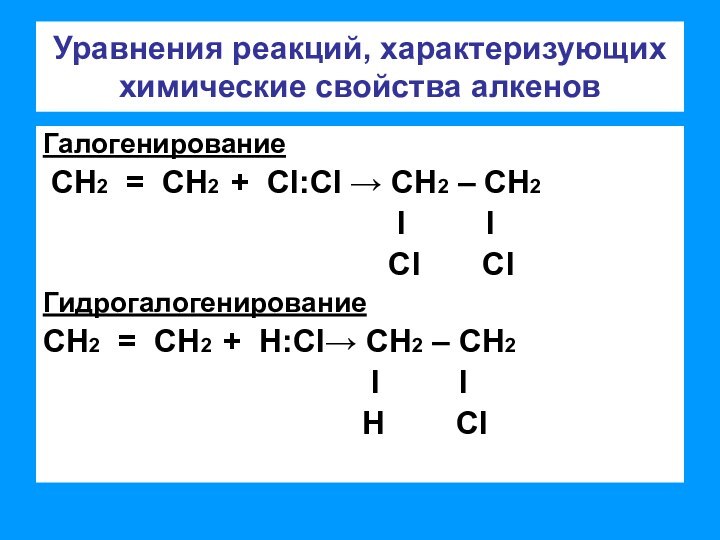
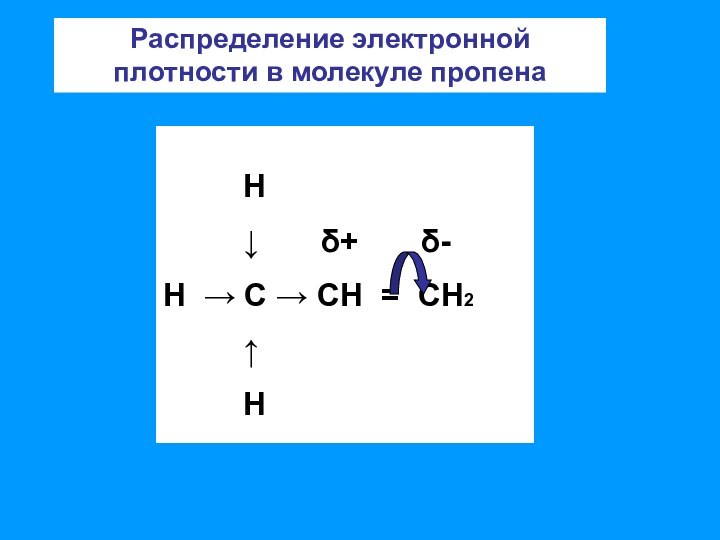
связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их
в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения алкенов;– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной σ-связи, которая практически не поляризуется и одной π-связи, которая достаточно легко поляризуется.