- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химия элементов
Содержание
- 2. Типы комплексных соединений. 1. АквакомплексыВ водных
- 3. АквакомплексыТермич. разложение:CuSO4·5H2O CuSO4·4H2O + H2O(г)CuSO4 + 4H2O(г)[Cu(H2O)4]SO4·H2O («медный купорос»)
- 4. Аквакомплексы[Fe(H2O)6]SO4·H2O («железный купорос»)
- 5. 2. ГидроксокомплексыПолучение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–;
- 6. 3. Аммины (аммиакаты)Получение: AgCl(т) + 2NH3·H2O(изб.) =
- 7. Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+
- 8. Получение:4 NaH + B(OCH3)3 = Na[BH4] +
- 9. 6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г²
- 10. Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж)
- 11. Правило Сиджвика для определения состава комплексов Устойчивым
- 12. Правило Сиджвика (примеры)* 27Co0 [Ar]3d74s2 || 36Kr*
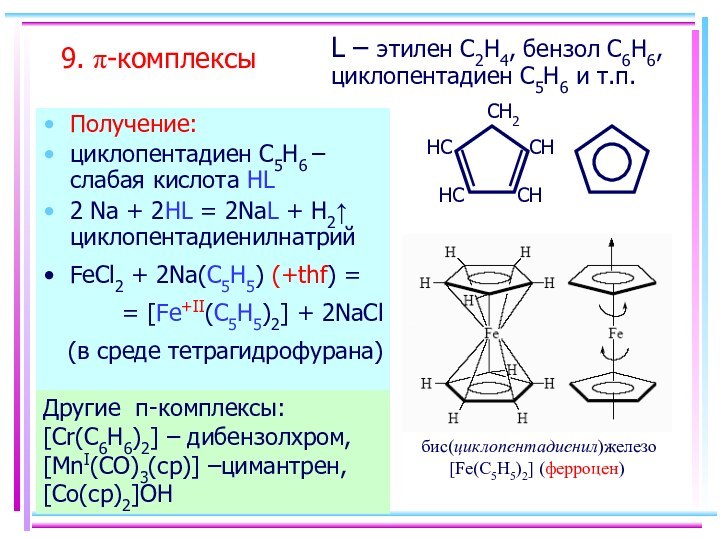
- 13. 9. p-комплексыПолучение:циклопентадиен С5H6 – слабая кислота HL2
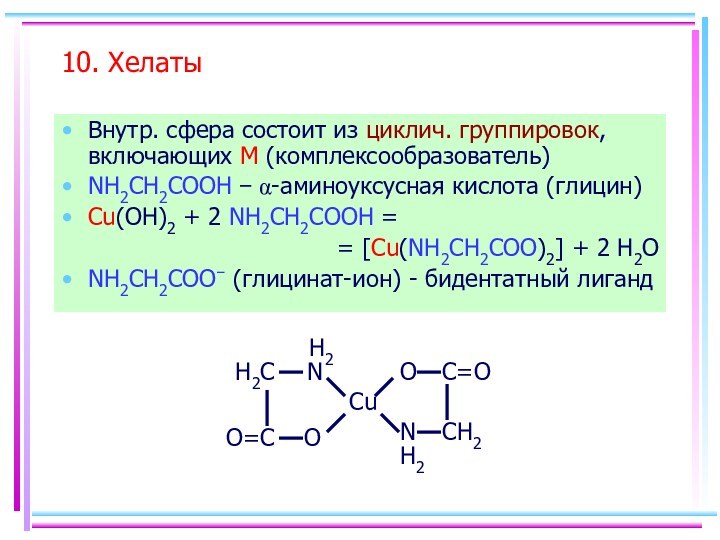
- 14. 10. Хелаты Внутр. сфера состоит из циклич.
- 15. Реакция Чугаева Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2Oбис(диметилглиоксимато)никель(II)
- 16. Методы синтеза комплексных соединенийРеакция обмена лигандовА) в
- 17. Методы синтеза комплексных соединенийД) ОВР + реакции
- 18. Решение задач. 1. Растворение осадка при комплексообразованииAgBr(т)
- 19. Решение задач. 2. Реакция обмена лигандов[Co(NH3)6]3+ +
- 20. Решение задач. 3. Разрушение комплекса[Cu(NH3)4]2+ + 4
- 21. Скачать презентацию
- 22. Похожие презентации

![Химия элементов Типы комплексных соединений. 1. АквакомплексыВ водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ …](/img/tmb/13/1299089/14ab310812b3afcff40443c4cc07df50-720x.jpg)
![Химия элементов АквакомплексыТермич. разложение:CuSO4·5H2O CuSO4·4H2O + H2O(г)CuSO4 + 4H2O(г)[Cu(H2O)4]SO4·H2O («медный купорос»)](/img/tmb/13/1299089/093b4eeacce3d6f1a938cd011354bee4-720x.jpg)
![Химия элементов Аквакомплексы[Fe(H2O)6]SO4·H2O («железный купорос»)](/img/tmb/13/1299089/0d35412c4e4d2a86f0115d31f21c8758-720x.jpg)
![Химия элементов 2. ГидроксокомплексыПолучение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7Разрушение: [Zn(OH)4]2– (+H3O+)](/img/tmb/13/1299089/700449e38d8994c4f97d9b9fddc43d39-720x.jpg)
![Химия элементов 3. Аммины (аммиакаты)Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2OРазрушение:[Ag(NH3)2]+ +](/img/tmb/13/1299089/e3691e74765edb9c7aee483cc75fd013-720x.jpg)
![Химия элементов Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2OРазрушение:[HgI4]2– +](/img/tmb/13/1299089/35b1cbe3a1c0861ca1f515a522714e40-720x.jpg)
![Химия элементов Получение:4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 °C) 4](/img/tmb/13/1299089/70e9bdbb6574776ea8faec4c45b65ff0-720x.jpg)
![Химия элементов 6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г² – галогены)Получение: KI + I2](/img/tmb/13/1299089/68b844ffb2cfc6f1edf606a9ed4abac7-720x.jpg)
 (ниже 50 °С)тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж)](/img/tmb/13/1299089/a3062051c58a9441c8b012b2c77520c6-720x.jpg)

![Химия элементов Правило Сиджвика (примеры)* 27Co0 [Ar]3d74s2 || 36Kr* 18 – 9 = 9e](/img/tmb/13/1299089/3c9e125de0eb630741fb60c202e9b34c-720x.jpg)
 + 2NH4+ + 2H2Oбис(диметилглиоксимато)никель(II)](/img/tmb/13/1299089/721cfeac0fb7d1bbc6701416d5462c68-720x.jpg)



![Химия элементов Решение задач. 2. Реакция обмена лигандов[Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– +](/img/tmb/13/1299089/dc843239933d7f5703bb81fd7b65fa3f-720x.jpg)
![Химия элементов Решение задач. 3. Разрушение комплекса[Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4](/img/tmb/13/1299089/ffb2dd5f73554ebc505408dc81d22219-720x.jpg)
![Химия элементов Решение задач. 4. Направление реакции CuCN(т) + H2O + HCN [Cu(CN)2]–](/img/tmb/13/1299089/3ff2fb9b602653248375aedec9ba9626-720x.jpg)
Слайд 3
Аквакомплексы
Термич. разложение:
CuSO4·5H2O
CuSO4·4H2O + H2O(г)
CuSO4 + 4H2O(г)
[Cu(H2O)4]SO4·H2O («медный
купорос»)
Слайд 5
2. Гидроксокомплексы
Получение:
Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–;
pH >> 7
Разрушение:
[Zn(OH)4]2– (+H3O+)
+ CH3COOH; CO2; NH4+ (сл.к-ты, pH 7)Zn(OH)2(т)
+ H3O+ (сильн.к-ты, pH < 7)
[Zn(H2O)4]2+
Образование гидроксокомплексов характерно для амфотерных элементов.
: OH–
Слайд 6
3. Аммины (аммиакаты)
Получение:
AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+
+Cl– + 2H2O
Разрушение:
[Ag(NH3)2]+ + H3O+ NH4+ + …
[Ag(NH3)2]+
+ I– AgI(т) + …[Ag(NH3)2]+ + t° NH3(г) + …
: NH3
Слайд 7
Получение:
HgI2(т) + 2I–(изб.) = [HgI4]2–
[Fe(H2O)6]3+ +
6NCS−=[Fe(NCS)6]3− + 6H2O
Разрушение:
[HgI4]2– + S2– = HgS(т) + 4I–
[Fe(NCS)6]3−
+ 4F− = [FeF4]− + 6NCS−4. Ацидокомплексы
: Х–
Слайд 8
Получение:
4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa
(при 250 °C)
4 LiH + AlCl3 = Li[AlH4]
+ 3LiCl 3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl
Разрушение:
Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 (ОВР)
2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 (ОВР)
5. Гидридокомплексы
: H–
Слайд 9 6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г² –
галогены)
Получение:
KI + I2 = K[I(I)2];
CsCl + IBr = Cs[I(Br)(Cl)]Разрушение:
K[I(I)2] + t° = KI + I2(г)
Cs[I(Br)(Cl)] + t° = CsCl + IBr(г)
7. Катионгалогены [ЭГ¢mГ²n]Z (Э, Г¢ и Г² – галогены)
Получение:
ICl3 + SbCl5 = [ICl2][SbCl6]; BrF3 + AsF5 = [BrF2][AsF6]
Свойства:
Ag[BrF4](s) + [BrF2][SbF6](s) = Ag[SbF6](s) + 2BrF3(ж) в среде BrF3(ж)
Слайд 10
Получение:
Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже
50 °С)
тетракарбонилникель(0)
Разрушение:
[Ni(CO)4](ж) + t° = Ni(т) +
4 CO(г) (выше 200 °С) [Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO + H2
8. Карбонилы
: CO
Состав карбонильных комплексов: [Cr(CO)6], [Mn2(CO)10], [Fe(CO)5], [Co2(CO)8] и др.
Слайд 11
Правило Сиджвика для определения состава комплексов
Устойчивым является
комплекс, в котором реализована 18-эл-ная оболочка из s-, p-
и d-электронов М и x эл. пар лигандов (L)26Fe0 [Ar]3d64s2 || 36Kr
18 – 8 = 10e –
или 36 – 26 = 10e –
x = 10/2 = 5 эл.пар (5 молекул CO)
[Fe(CO)5] пентакарбонилжелезо
Слайд 12
Правило Сиджвика (примеры)
* 27Co0 [Ar]3d74s2 || 36Kr
* 18
– 9 = 9e –;
* х = 9/2
= 4,5 (?)* радикал [·Co(CO)4]
* тетракарбонилкобальт
(неуст.)
* димер [Co2(CO)8] (уст.) октакарбонилдикобальт
23V0 [Ar]3d34s2 || 36Kr
18–5 = 13e –;
х = 13/2 = 6,5 (?)
радикал [·V(CO)6] (неуст.)
или компл.соединение состава K[:V–I(CO)6] гексакарбонилванадат(-I) калия (уст.)
Слайд 13
9. p-комплексы
Получение:
циклопентадиен С5H6 – слабая кислота HL
2 Na
+ 2HL = 2NaL + H2 циклопентадиенилнатрий
FeCl2 + 2Na(C5H5)
(+thf) = = [Fe+II(C5H5)2] + 2NaCl
(в среде тетрагидрофурана)
Другие -комплексы: [Cr(C6H6)2] – дибензолхром, [MnI(CO)3(cp)] –цимантрен, [Co(cp)2]OH
L – этилен C2H4, бензол C6H6, циклопентадиен С5H6 и т.п.
Слайд 14
10. Хелаты
Внутр. сфера состоит из циклич. группировок,
включающих M (комплексообразователь)
NH2CH2COOH - a-аминоуксусная кислота (глицин)
Cu(OH)2 + 2
NH2CH2COOH = = [Cu(NH2CH2COO)2] + 2 H2O
NH2CH2COO- (глицинат-ион) - бидентатный лиганд
Слайд 15
Реакция Чугаева
Ni2+ + 2 NH3·H2O + 2H2L
=
= [Ni(HL)2](т) + 2NH4+ + 2H2O
бис(диметилглиоксимато)никель(II)
Слайд 16
Методы синтеза комплексных соединений
Реакция обмена лигандов
А) в водном
растворе (обр, принцип Ле Шателье):
[Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+
+ 8H2O(обр. прод.) > (обр. исх.реаг.)
Б) в неводном растворителе:
[Al(H2O)6]3+ + NH3·H2O
[Al(H2O)6]3+(s) + 6NH3(ж) = [Al(NH3)6]3+(s) + 6H2O(s)
В) без растворителя:
[Ni(H2O)6]Cl2(т) + 6NH3(г) = [Ni(NH3)6]Cl2(т) +6H2O(г)
Г) внутримол. обмен лигандов в тв. фазе:
2[Co(H2O)6]Cl2(т) + t° = Co[CoCl4](т) + 12H2O
розовый синий
Слайд 17
Методы синтеза комплексных соединений
Д) ОВР + реакции обмена
лигандов
+Ок.+ L [СoII(H2O)6]2+ [СoIIIL6]3+
Ок.: H2O2, KNO2 … L – NH3, NO2– …
Примеры:
2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2
CoIICl2 + 7KNO2 + 2CH3COOH =
= K3[CoIII(NO2)6] + NO + 2KCl + 2CH3COOK + H2O
+ Вс
[NiII(CN)4]2– [Ni0(CN)4]4–
Слайд 18
Решение задач. 1. Растворение осадка при комплексообразовании
AgBr(т)
Ag+ + Br – ; ПРAgBr = 7,7·10–13
Ag+ +
2 SO3S2– [Ag(SO3S)2]3– ; обр = 4·1013AgBr(т) + 2 SO3S2– [Ag(SO3S)2]3– + Br –;
Kc = ?
Kc = ПРAgBr обр = 7,7·10–13 4·1013 = 30,8 >> 1
Наблюдается растворение осадка (смещение равновесия вправо )
= ПРAgBr обр
Слайд 19
Решение задач. 2. Реакция обмена лигандов
[Co(NH3)6]3+ + 6
CN– [Co(CN)6]3– + 6 NH3 ;
Kc =
? Co3+ + 6 NH3 [Co(NH3)6]3+ ; обр(1) = 1,6·1035
Co3+ + 6 CN– [Co(CN)6]3– ; обр(2) = 1,0·1064
Kc = обр(2) / обр(1) = (1,0·1064)/(1,6·1035) = 6,2·1029 >> 1
Наблюдается смещение равновесия вправо
обр(2)
обр(1)
Слайд 20
Решение задач. 3. Разрушение комплекса
[Cu(NH3)4]2+ + 4 H3O+
[Cu(H2O)4]2+ + 4 NH4+ ;
Kc = ?
Cu2+ + 4 NH3 [Cu(NH3)4]2+ ; обр = 7,9·1012
NH4+ + 2H2O NH3·H2O + H3O+ ; Kк = 5,75·10–10
Kc = 1 / (7,9·1012·5,754·10–40 ) = 1,16·1020 >> 1
Наблюдается разрушение аммиачного комплекса в кислотной среде (смещение равновесия вправо )
1
обр Kк 4





























