- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химия Гидролиз солей
Содержание
- 2. Цели урока:Ознакомиться с понятием гидролиза солей.Рассмотреть типы
- 4. Среды водных растворов электролитовpH =7pH < 7pH > 7
- 5. Определение типа среды с помощью индикаторовсиняякраснаяфиолетоваяЛакмусмалиноваябесцветнаябесцветнаяФенол- фталеинжелтаярозоваяоранжеваяМетиловый оранжевыйщелочнойкислотнойнейтральнойОкраска индикатора в средеИндикатор
- 6. Лабораторный опыт Таблица № 1НейтральнаяpH = 7бесцветнаяоранжеваяфиолетоваяNa2SO4КислотнаяpH < 7бесцветнаярозоваякраснаяZnSO4ЩелочнаяpH > 7малиноваяжелтаясиняяNa2CO3Фенол-фталеинМетил-оранжЛакмусСреда,pHОкраска индикатораСоли373246
- 7. Что такое гидролиз?Гидролиз(от греческого hydro – вода;lysis – разложение)
- 8. Классификация солейсильным основанием и слабой кислотойслабым
- 9. Сущность гидролиза1. Na2CO3
- 10. Определение гидролизаГидролиз соли – это химическая реакция
- 11. Уравнения гидролиза← Na2CO3 → NaOHсильное основаниеH2CO3слабая
- 12. Уравнения гидролиза← ZnSO4 → Zn(ОН)2слабое основаниеH2SO4сильная
- 13. Гидролиз солей3.2.1.№Реакция среды, pHТип гидролизаСоли, образованныенейтральная среда
- 14. Задание. Определите реакцию среды водных растворов солей.
- 15. Экспериментальная задачаВ трех пронумерованных пробирках даны
- 16. Таблица № 3
- 17. Экспериментальная задачаИндикатор синий (pH > 7)1 -
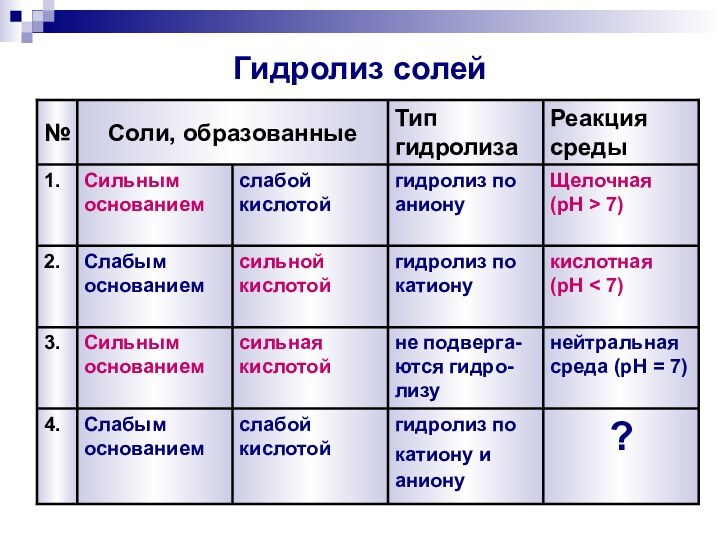
- 18. Гидролиз солей4.3.2.1.№Реакция средыТип гидролизаСоли, образованные?гидролиз покатиону ианиону
- 19. Готовимся к ЕГЭ 1. Установите соответствие: Формула соли Тип гидролиза 1.
- 20. Готовимся к ЕГЭ 2. Установите соответствие: Формула соли Среда раствора 1.
- 21. Готовимся к ЕГЭ 3. Установите соответствие: Формула соли Значение pH 1.
- 22. Домашнее задание§ 16 с. 163 – 168, упр. 3,4
- 23. Человек рождается на свет,Чтоб творить, дерзать –
- 24. Скачать презентацию
- 25. Похожие презентации























Слайд 2
Цели урока:
Ознакомиться с понятием гидролиза солей.
Рассмотреть типы гидролиза.
Научиться
составлять ионные уравнения гидролиза солей.
по её формуле.
Слайд 5
Определение типа среды с помощью индикаторов
синяя
красная
фиолетовая
Лакмус
малиновая
бесцветная
бесцветная
Фенол-
фталеин
желтая
розовая
оранжевая
Метиловый оранжевый
щелочной
кислотной
нейтральной
Окраска индикатора
в среде
Индикатор
Слайд 6
Лабораторный опыт
Таблица № 1
Нейтральная
pH = 7
бесцветная
оранжевая
фиолетовая
Na2SO4
Кислотная
pH < 7
бесцветная
розовая
красная
ZnSO4
Щелочная
pH
> 7
малиновая
желтая
синяя
Na2CO3
Фенол-фталеин
Метил-оранж
Лакмус
Среда,
pH
Окраска индикатора
Соли
37
32
46
Слайд 8
Классификация солей
сильным
основанием
и слабой кислотой
слабым
основанием
и сильной
кислотой
сильным
основанием
и
сильной
кислотой
Слайд 9
Сущность гидролиза
1. Na2CO3 2Na+
+ CO32 -
(катион) (анион)H2O ⇄ OH - + H+
2. ZnSO4 Zn2+ + SO42-
(катион) (анион)
H2O ⇄ OH - + H+
3. Na2SO4 2Na+ + SO42 -
(катион) (анион)
H2O ⇄ OH - + H+
Гидролиз
по аниону
Гидролиз
по катиону
Гидролиз
не протекает
Слайд 10
Определение гидролиза
Гидролиз соли – это химическая реакция обмена
соли с водой,
в результате которой ионы слабого
электролита, входящие в состав соли, соединяются с составными частями воды: H+ и OH- .
Слайд 11
Уравнения гидролиза
← Na2CO3 →
NaOH
сильное
основание
H2CO3
слабая
кислота
Na2CO3 → 2Na+
+ CO32 -
CO32 - + HOH ⇄ HCO3- + OH -
Слайд 12
Уравнения гидролиза
← ZnSO4 →
Zn(ОН)2
слабое
основание
H2SO4
сильная
кислота
ZnSO4 → Zn2+
+ SO42 -
Zn2 + + HOH ⇄ ZnOH + + H +
Слайд 13
Гидролиз солей
3.
2.
1.
№
Реакция среды, pH
Тип гидролиза
Соли, образованные
нейтральная среда (pH
= 7)
не
подвергаются гидролизу
сильная кислотой
Сильным основанием
кислотная
(pH < 7)
гидролиз
по
катионусильной кислотой
Слабым основанием
щелочная
(pH > 7)
гидролиз
по аниону
слабой кислотой
Сильным основанием
Слайд 14 Задание. Определите реакцию среды водных растворов солей. Таблица №
2
NaNO3
K2S
Na2SiO3
5.
NH4NO3
LiNO3
NaClO4
4.
KMnO4
KI
K3PO 4
3.
Na2SO3
FeCl3
CuSO4
2.
KCl
NaNO2
Li2SO4
1.
III ряд
II ряд
I ряд
№
Н
К
Щ
Н
Щ
Щ
Н
Н
К
Щ
Н
Щ
Н
К
Н
н-нейтральная; к – кислотная; щ - щелочная
Слайд 15
Экспериментальная задача
В трех пронумерованных пробирках
даны растворы солей:
ZnCl2, K2S, KCl.
а) Исследуйте каждый из них
универсальной индикаторной бумагой;б) распознайте данные вещества;
в) укажите тип гидролиза;
г) напишите ионные уравнения гидролиза.
Слайд 17
Экспериментальная задача
Индикатор синий
(pH > 7)
1 - K2S
Индикатор
не изменяет окраску
(pH =7)
2 - KCl
Индикатор красный
(pH < 7)
3
– ZnCl2
Слайд 18
Гидролиз солей
4.
3.
2.
1.
№
Реакция среды
Тип гидролиза
Соли, образованные
?
гидролиз по
катиону и
аниону
слабой кислотой
Слабым
основанием
нейтральная среда (pH = 7)
не подверга-ются гидро-лизу
сильная кислотой
Сильным основанием
кислотная
(pH
< 7)гидролиз по катиону
сильной кислотой
Слабым основанием
Щелочная
(pH > 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
Слайд 19
Готовимся к ЕГЭ
1. Установите соответствие:
Формула соли Тип гидролиза
1. FeCl2 А.
по катиону
2. Ba(NO3)2
Б. по аниону3. KF В. не гидролизуется
4. Na3PO4
Ответ:
1А;
2В;
3Б;
4Б
Слайд 20
Готовимся к ЕГЭ
2. Установите соответствие:
Формула соли Среда раствора
1. K2SO4 А.
кислотная
2. Li2CO3
Б. щелочная3. NH4Br В. нейтральная
4. CrCl3
Ответ:
1В;
2Б;
3А;
4А
Слайд 21
Готовимся к ЕГЭ
3. Установите соответствие:
Формула соли Значение pH
1. K2SiO3 А.
pH < 7
2. LiNO3
Б. pH > 73. CuCl2 В. pH = 7
4. NaCl
Ответ:
1Б;
2В;
3А;
4В
Слайд 23
Человек рождается на свет,
Чтоб творить, дерзать – и
не иначе,
Чтоб оставить в жизни добрый след
И решить все
трудные задачи.Человек рождается на свет…
Для чего? Ищите свой ответ!