- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Ионные уравнения
Содержание
- 2. Ионные уравнения
- 3. Реакции, осуществляемые в растворах между ионами, называются ионными, а уравнения таких реакций - ионными уравнениями
- 4. Правила составления ионных уравнений. 1. Формулы малодиссоциирующих,
- 5. Алгоритм составления ионных уравнений. Алгоритм составления ионного
- 6. 4. Составить полное ионное уравнение (коэффициент перед
- 7. Скачать презентацию
- 8. Похожие презентации
Ионные уравнения






Слайд 3 Реакции, осуществляемые в растворах между ионами, называются ионными,
а уравнения таких реакций - ионными уравнениями
Слайд 4
Правила составления ионных уравнений.
1. Формулы малодиссоциирующих, газообразных
веществ и неэлектролитов изображают в молекулярном виде.
2. С помощью
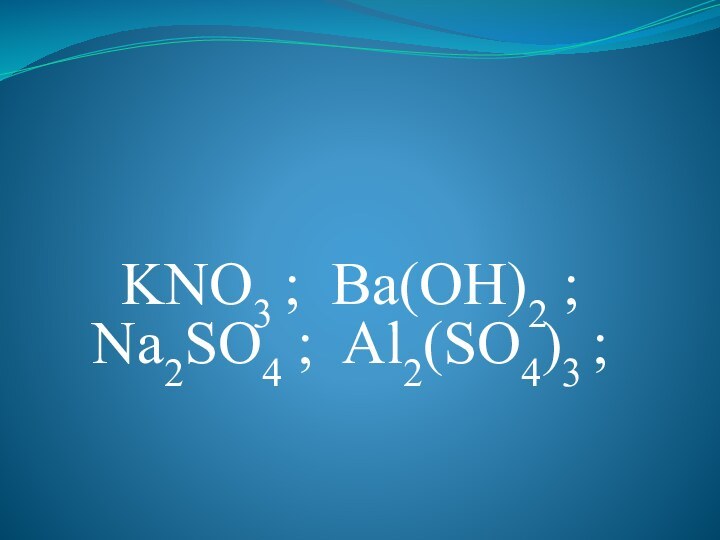
знака ( ↑ - газ, ↑ - осадок) отмечают «путь удаления» вещества из сферы реакции (раствора).3. Формулы сильных электролитов записываются в виде ионов.
4. Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в виде ионов.
5. Если малорастворимое вещество образуется в результате реакции, то оно выпадает в осадок, и в ионном уравнении его записывают в виде молекулы.
6. Сумма зарядов ионов в левой части уравнения должна быть равна сумме зарядов ионов в правой части.
Слайд 5
Алгоритм составления ионных уравнений.
Алгоритм составления ионного уравнения реакции
Выполнение
1.
Записать молекулярное уравнение реакции:
CuSO4 + 2 NaOH = Cu(OH)2
+ Na2SO42. С помощью таблицы растворимости определить растворимость каждого вещества:
P P H P
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
3. Решить, уравнения диссоциации каких исходных веществ и продуктов реакции каких исходных веществ и продуктов реакции нужно записывать:
CuSO4 = Cu2+ + SO4 2-
NaOH = Na+ + OH-
Na2SO4 = 2 Na+ + SO4 2-
Cu(OH)2 - малодиссоциирующее
Слайд 6 4. Составить полное ионное уравнение (коэффициент перед молекулой
= коэффициенты перед ионами):
Cu2+ + SO4 2- + 2Na+
+2 OH- = Cu(OH)2 +2 Na++SO4 2-5.Найти одинаковые ионы и сократить их:
Cu2+ + SO4 2- + 2Na+ + 2OH- = Cu(OH)2 +2 Na++SO4 2-
6. Записать сокращенное ионное уравнение:
Cu2+ + 2OH- = Cu(OH)2