Слайд 2
Строение атома
Заряд ядра атома +6
2
энергетических уровня
4 электрона на внешнем энергетическом уровне
…2S22P2 – строение
внешнего энергетического уровня
для завершения внешнего энергетического уровня атом может отдавать 4 электрона:
С0 - 4е → С+4, выступает в роли восстановителя
для завершения внешнего энергетического уровня атом может принимать 4 электрона:
С0 + 4е → С-4, выступает в роли окислителя
Слайд 3
Углерод- простое вещество
Образует аллотропные модификации
Причина аллотропии:
различное строение кристаллической решетки:
алмаз – объемная тетраэдрическая решетка
графит –
плоскостная атомная решетка
карбин - линейная решетка
фуллерен – экзотическая модификация в виде футбольных мячей
Слайд 4
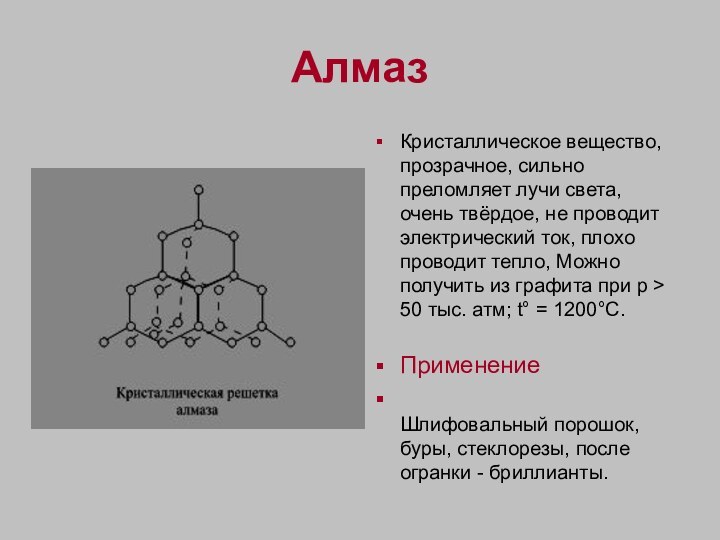
Алмаз
Кристаллическое вещество, прозрачное, сильно преломляет лучи света,
очень твёрдое, не проводит электрический ток, плохо проводит тепло,
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
Применение
Шлифовальный порошок, буры, стеклорезы, после огранки - бриллианты.
Слайд 5
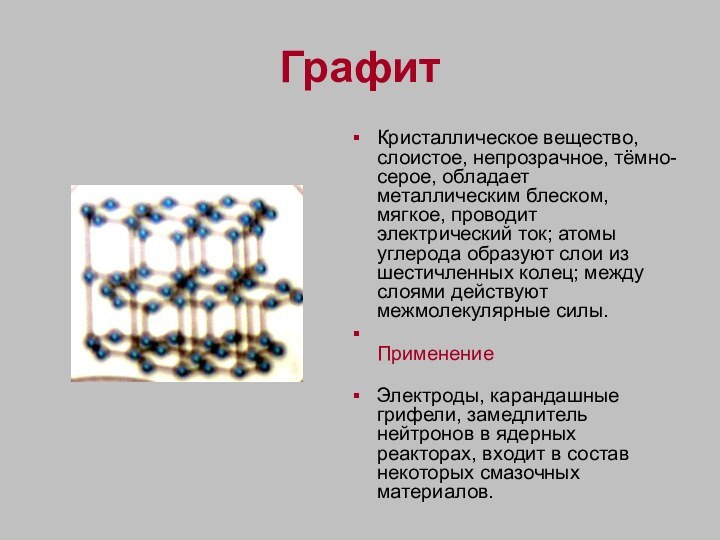
Графит
Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим
блеском, мягкое, проводит электрический ток; атомы углерода образуют слои
из шестичленных колец; между слоями действуют межмолекулярные силы.
Применение
Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
Слайд 6
Карбин
Чёрный порошок; полупроводник.
Состоит из линейных цепочек –CºC–CºC–
и =С=С=С=С=
При нагревании переходит в графит.
Модель молекулы фуллерена
Слайд 7
Адсорбция
Адсорбция - поглощение газообразных или растворённых веществ поверхностью
твёрдого вещества.
Обратный процесс - выделение этих поглощённых веществ -
десорбция.
Применение адсорбции
Очистка от примесей (в производстве сахара и др.), для защиты органов дыхания (противогазы), в медицине (таблетки "Карболен") и др.
Слайд 8
Интересная история, произошедшая с учеными М.Фарадеем и Г.
Дэви
Путешествуя, они остановились в одном замке, во время беседы
с хозяином этого замка случилось следующее:
Герцог не верил, что алмаз состоит из углерода. Он снял свой перстень с алмазом и сказал: «Сожгите его, тогда поверю!» И, когда увидел результат, воскликнул: «Удивительно, мой алмаз испарился!»
На что ученые ему твердо ответили: «Не испарился, а сгорел!»
Был у герцога алмаз и не стало его….
Вот что значит не верить ученым!
Слайд 9
Химические свойства
Углерод - малоактивен, на холоду реагирует только
со фтором; химическая активность проявляется при высоких температурах.
Восстановительные свойства
Взаимодействие
с избытком кислорода:
C0 + O2 → C+4O2
При недостатке кислорода образуется оксид углерода (II)
2C0 + O2 → 2C+2O
Взаимодействие с фтором:
С + 2F2 → CF4
с водяным паром
C0 + H2O → С+2O + H2
с оксидами металлов
C0 + 2CuO → 2Cu + C+4O2
с кислотами – окислителями:
C0 + 2H2SO4(конц.) → С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O
Слайд 10
Окислительные свойства
с некоторыми металлами образует карбиды
4Al + 3C0 → Al4C3
Ca + 2C0 → CaC2-4
с водородом
C0 + 2H2 → CH4
Углерод – это особый химический элемент, он основа многообразия органических соединений, из которых построены все живые организмы на нашей планете.
Слайд 11
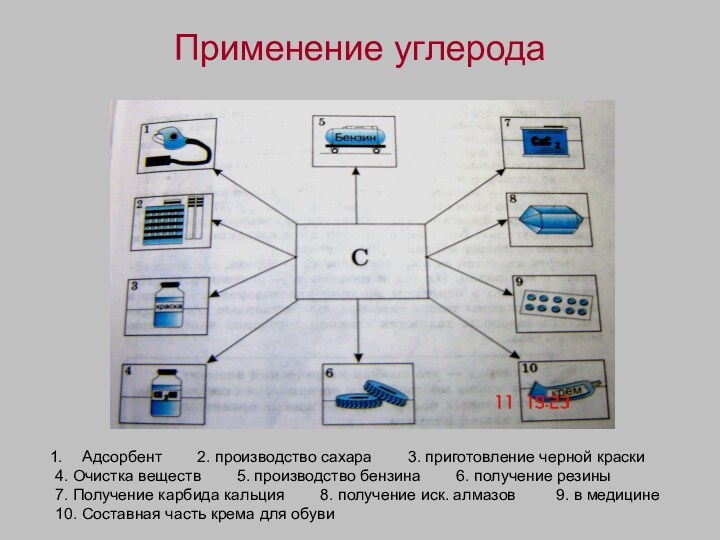
Применение углерода
Адсорбент 2. производство сахара
3. приготовление черной краски
4. Очистка веществ
5. производство бензина 6. получение резины
7. Получение карбида кальция 8. получение иск. алмазов 9. в медицине
10. Составная часть крема для обуви
Слайд 12
Соединения углерода
Оксид углерода (II) CO
Угарный газ; бесцветный, без
запаха, малорастворим в воде, растворим в органических растворителях, ядовит,
t°кип = -192°C; t пл. = -205°C.
Слайд 13
Получение
В промышленности (в газогенераторах):
C + O2→ CO2
CO2 + C → 2CO
В лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH → H2O + CO
H2C2O4 → CO2↑ + H2O + CO↑
Слайд 14
Химические свойства
При обычных условиях CO инертен; при нагревании
– восстановитель; несолеобразующий оксид.
Взаимодействие с кислородом
2C+2O + O2 → 2C+4O2↑
Взаимодействиес оксидами металлов
C+2O + CuO → Сu + C+4O2↑
Взаимодействие с хлором (на свету)
CO + Cl2 → COCl2(фосген)
Реагирует с расплавами щелочей (под давлением)
CO + NaOH → HCOONa
(формиат натрия)
Слайд 15
Оксид углерода (IV) СO2
O=C=O
углекислый газ, бесцветный, без запаха,
растворимость в воде – в 1V H2O растворяется
0,9 V CO2 (при нормальных условиях);
тяжелее воздуха;
t°пл.= -78,5°C
(твёрдый CO2 называется "сухой лёд");
не поддерживает горение.
Слайд 16
Получение оксида углерода (IV)
Термическим разложением солей угольной кислоты
(карбонатов). Обжиг известняка:
CaCO3 → CaO + CO2↑
Действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
NaHCO3 + HCl → NaCl + H2O + CO2↑
Слайд 18
Химические свойства оксида углерода (IV)
Кислотный оксид: реагирует
с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
При повышенной температуре может проявлять
окислительные свойства
С+4O2 + 2Mg → 2Mg+2O + C0
Качественная реакция - помутнение известковой воды:
Ca(OH)2 + CO2 → CaCO3↓+ H2O
(белый осадок)
При длительном пропускании CO2 через известковую воду осадок исчезает, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2→ Сa(HCO3)2
Слайд 19
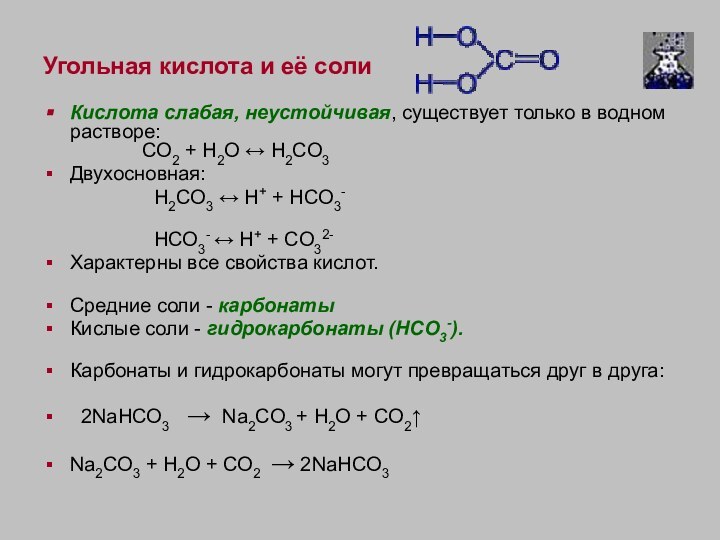
Угольная кислота и её соли
Кислота слабая, неустойчивая, существует только в водном растворе:
CO2 + H2O ↔ H2CO3
Двухосновная:
H2CO3 ↔ H+ + HCO3-
HCO3- ↔ H+ + CO32-
Характерны все свойства кислот.
Cредние соли - карбонаты
Кислые соли - гидрокарбонаты (HCO3-).
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 → Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2 → 2NaHCO3
Слайд 20
Карбонаты металлов (кроме щелочных металлов) при нагревании разлагаются
с образованием оксида:
CuCO3 →
CuO + CO2↑
Качественная реакция - "вскипание" при действии сильной кислоты:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CO32- + 2H+ → H2O + CO2↑