- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Качественная реакция на II аналитическую группу
Содержание
- 2. Опыт 1. Действие группового реагента На 2
- 3. Прибавили раствор соляной кислоты (1-2 капли). Наблюдали
- 4. Опыт 2. качественная реакция на катионы СЕРЕБРАС
- 5. С раствором натрия тиосульфата.На предметное стекло
- 6. С формальдегидом в аммиачной среде (реакция
- 7. Действие карбоната натрия.При действии Na2CO3, на раствор
- 8. Действие хромата калия.Фильтровальную бумагу смочили раствором K2CrO4.
- 9. Нанесли каплю раствора соли серебра. Пятно окрасилось
- 10. Опыт 3. качественная реакция на катионы СВИНЦАС
- 11. С раствором калия хромата.На предметное стекло поместили
- 12. Действие гидроокисей натрия.В две пробирки налили по
- 13. Действие с серной кислотой.При действии серной кислоты
- 14. Опыт 4. Анализ катионов ртутиДействие гидроокисей натрия.При
- 15. Гидроксид аммония с ртутью (I) дал осадок
- 16. Действие иодида калия.Иодид калия с ртутью (II)
- 17. Систематический ход анализаИсследуемую задачу разделяли на 2
- 18. В пробирку с центрифугатом добавили 2-3 капли
- 19. Скачать презентацию
- 20. Похожие презентации
Опыт 1. Действие группового реагента На 2 предметные стекла поместили по 2 капли растворов солей серебра и свинца.


















Слайд 3 Прибавили раствор соляной кислоты (1-2 капли). Наблюдали –
выпадение осадков белого цвета.
Ag+ + Cl- = AgCl↓
Pb2+ + 2Cl- = PbCl2↓
Слайд 4
Опыт 2. качественная реакция на катионы СЕРЕБРА
С раствором
калия иодида.
На предметное стекло поместили 1- 2 капли раствора
соли нитрата серебра и добавили 1 каплю раствора калия иодида. Наблюдали – жёлтый осадок.AgNO3+ KI = AgI↓ + KNO3
Слайд 5
С раствором натрия тиосульфата.
На предметное стекло поместили
2 капли раствора нитрата серебра, прибавили 2 капли раствора
тиосульфата натрия. Наблюдали – образование белого осадка, переходящего в желтый, затем – в черный.2AgNO3+Na2S2O3= Ag2S2O3↓ +2NaNO3
Ag2S2O3=Ag2SO3+S↓
Ag2SO3+S↓+H2O= Ag2S↓+H2SO4
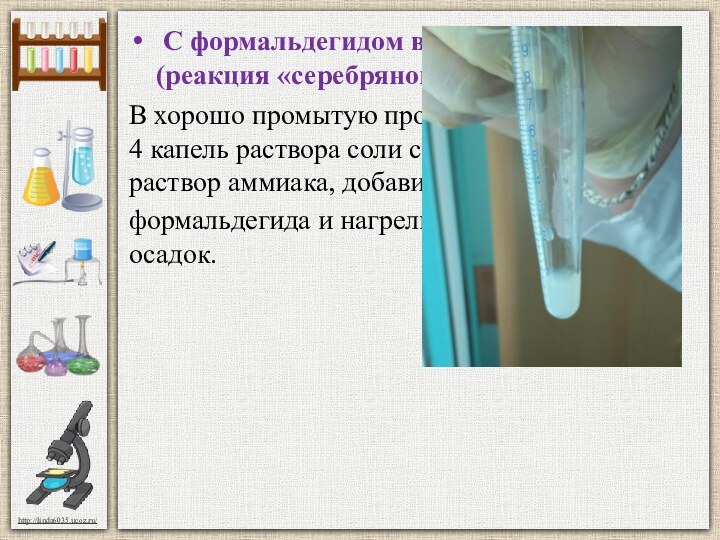
Слайд 6 С формальдегидом в аммиачной среде (реакция «серебряного
зеркала»).
В хорошо промытую пробирку прибавили 3 - 4 капель
раствора соли серебра и 3-4 капель раствор аммиака, добавили 3-4 капель формальдегида и нагрели. Наблюдали белый осадок.HCOH+2AgNO3+3NH4OH=2Ag↓+HCOONH4+ 2H2O+ 2NH4NO3
Слайд 7
Действие карбоната натрия.
При действии Na2CO3, на раствор соли
серебра образовался AgCO3. Наблюдали жёлтый цвет, на воздухе буреет.
Слайд 9 Нанесли каплю раствора соли серебра. Пятно окрасилось в
фиолетовый цвет.
K2CrO4 + AgNO3 -> K2NO3 + AgCrO4
Слайд 10
Опыт 3. качественная реакция на катионы СВИНЦА
С раствором
калия иодида (реакция « золотой струи»)
В пробирку поместили по
3-4 капли раствора соли свинца (II) и раствора иодида калия. К полученному осадку прилили 3-4 капли очищенной воды и 3-4 капли разведенной уксусной кислоты, нагрели до растворения осадка, вылили полученный раствор в холодную воду. Наблюдали движение «золотой струи» при взбалтывании. Pb(NO3)2+ 2KI=PbI2↓+2KNO3
Слайд 11
С раствором калия хромата.
На предметное стекло поместили 2
капли соли свинца раствора и 2 капли раствора хромата
калия. Наблюдали – образование желтого осадка.Pb(NO3)2+K2CrO4=
PbCrO4↓ + 2KNO3
Слайд 12
Действие гидроокисей натрия.
В две пробирки налили по несколько
капель соли свинца. В одну пробирку прибавили такой же
объём раствора NaOH, а в другую NH4OH. Наблюдали – в первой пробирки обесцвечивание, а в другой пробирки образование белого осадка.Pb(NO3)2 + 2NaOH=Pb(OH)2↓ + 2NaNO3
Pb(NO3)2 + NH4OH=PbOH+NH4(NO3)2
Слайд 13
Действие с серной кислотой.
При действии серной кислоты на
соли свинца образовался PbSO4 – очень мало растворимая соль.
Слайд 14
Опыт 4. Анализ катионов ртути
Действие гидроокисей натрия.
При действии
едкого щелоча NaOH на ртуть (I) образовался чёрный осадок
Hg2O, растворяющийся в HNO3.Hg2(NO3)2 + 2NaOH => Hg2O + Н2O+2NaNO3
Действие щелочей на ртуть (II) вызывал выпадение оранжевого (жёлтого) осадка HgO, растворяющийся в разбавленных кислотах.
Hg(NO3)2 + 2NaOH => HgO + H2O + 2NaNO3.
Слайд 15 Гидроксид аммония с ртутью (I) дал осадок амидосоединения
и металлической ртути (чёрный цвет осадка обусловлен выделением металлической
ртути):Hg2Cl2+2NH4OH=NH2HCl↓ +Hg↓ +NH4Cl+2H2O
Осадок нерастворим в избытке реактива.
При взаимодействии аммиака с ртутью (II) образовался белый осадок амидосоединения, растворяющийся в избытке реактива:
HgCl2+2NH4OH=NH2HgCl↓+NH4Cl+2H2O
Слайд 16
Действие иодида калия.
Иодид калия с ртутью (II) образовал
красный осадок HgJ2:
Hg(NO3)2+2KJ=HgJ2+2KNO3.
В избытке реактива происходило образование комплексной соли
K2[HgJ4], при этом раствор обесцветился.Иодид калия с ртутью (I) дал жёлтый осадок Hg2J2.
Hg2J2+2KJ=K2[HgJ4]+Hg↓.





























