- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Непредельные углеводороды. Алкены
Содержание
- 2. Содержание1.Определение2.Номенклатура алкенов3.Изомерия алкенов4.Строение алкенов5.Получение алкенов6.Физические свойства7.Химические свойства8.Применение алкенов
- 3. Определение Алкены – непредельные углеводороды, в молекулах
- 4. Номенклатура алкенов
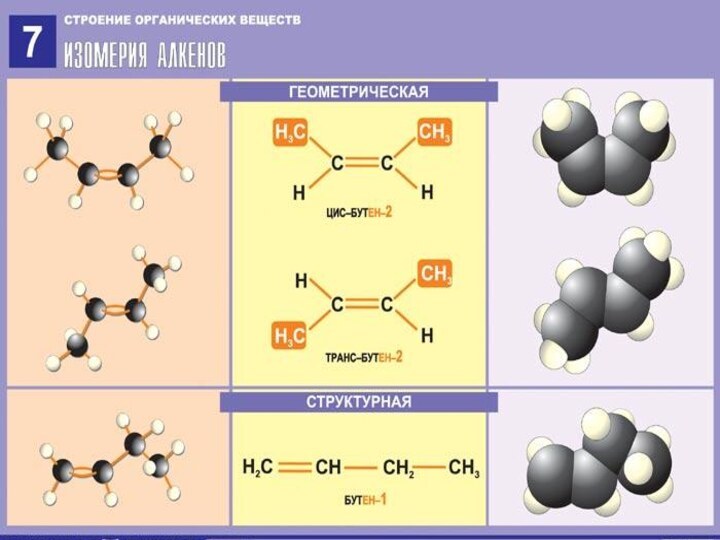
- 5. Изомерия алкенов
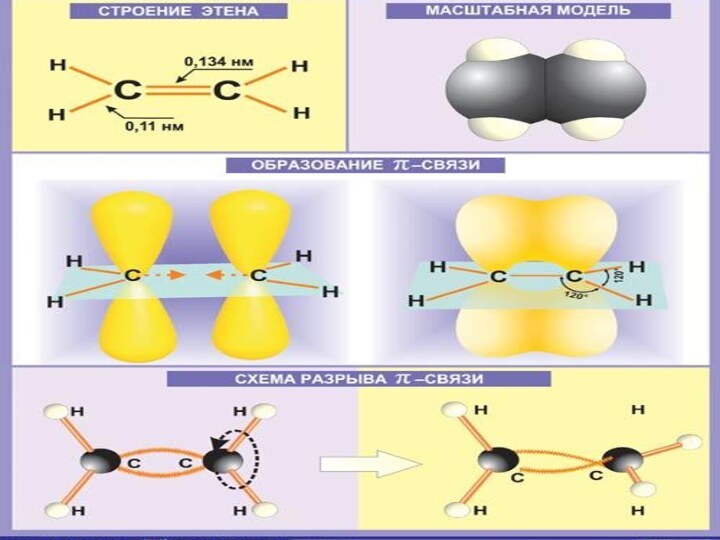
- 6. Строение алкенов
- 7. Строение алкенов
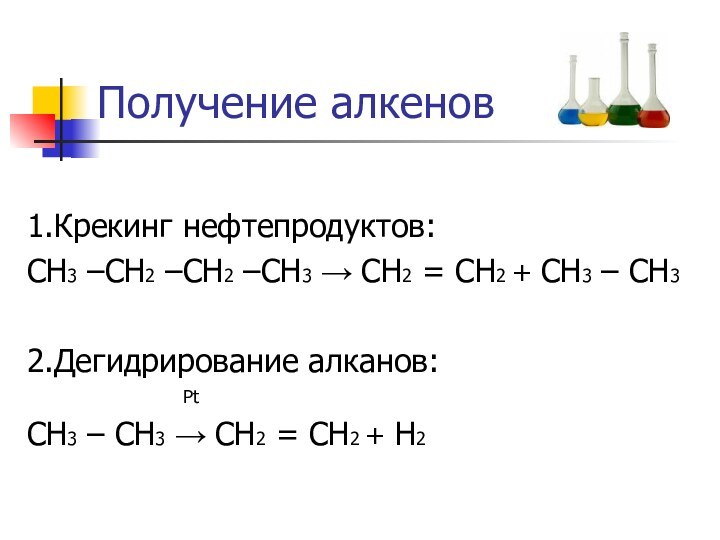
- 8. Получение алкенов1.Крекинг нефтепродуктов:СН3 –СН2 –СН2 –СН3 →
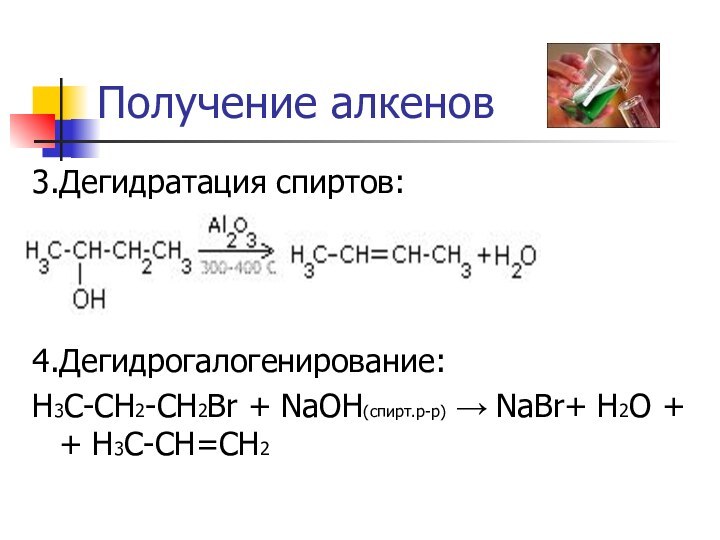
- 9. Получение алкенов3.Дегидратация спиртов:4.Дегидрогалогенирование:H3C-CH2-CH2Br + NaOH(спирт.р-р) → NaBr+ H2O + + H3C-CH=CH2
- 10. Получение алкенов5.Дегалогенирование:
- 11. Физические свойства Этен,пропен, бутен – газыС5Н10 – С16Н32 - жидкости Высшие алкены – тв.вещества
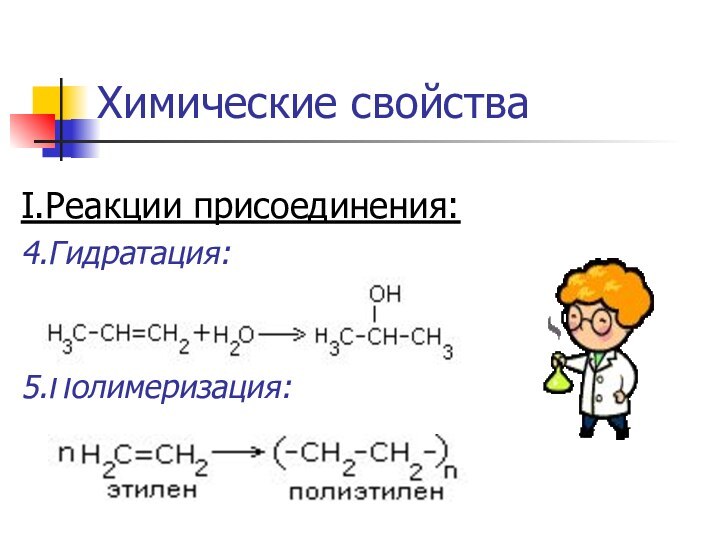
- 12. Химические свойстваI.Реакции присоединения:1.Гидрирование : CH2=CH-CH3+Н2 → CH3-CH2-CH3
- 13. Химические свойстваI.Реакции присоединения:4.Гидратация:5.Полимеризация:
- 14. Химические свойстваII.Реакции окисления:1.Полное окисление (горение): С2Н4 +
- 15. Применение алкенов
- 16. Скачать презентацию
- 17. Похожие презентации
Содержание1.Определение2.Номенклатура алкенов3.Изомерия алкенов4.Строение алкенов5.Получение алкенов6.Физические свойства7.Химические свойства8.Применение алкенов










Слайд 2
Содержание
1.Определение
2.Номенклатура алкенов
3.Изомерия алкенов
4.Строение алкенов
5.Получение алкенов
6.Физические свойства
7.Химические свойства
8.Применение алкенов
Слайд 3
Определение
Алкены – непредельные углеводороды, в молекулах которых
между атомами углерода имеется одна двойная связь.
СnH2n , где n ≥2
Слайд 4
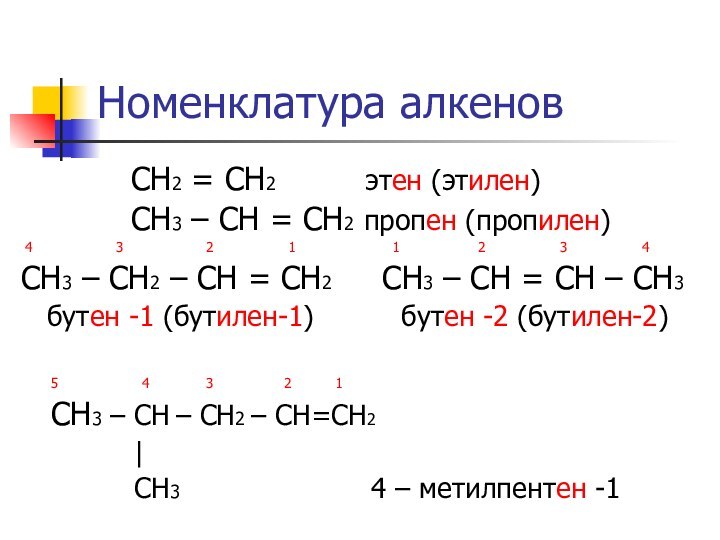
Номенклатура алкенов
СН2
= СН2 этен (этилен)
СН3 – СН = СН2 пропен (пропилен)4 3 2 1 1 2 3 4
СН3 – СН2 – СН = СН2 СН3 – СН = СН – СН3
бутен -1 (бутилен-1) бутен -2 (бутилен-2)
5 4 3 2 1
СН3 – СН – CH2 – CH=CH2
|
CH3 4 – метилпентен -1
Слайд 6
Строение алкенов
СН2 = СН2 этилен (этен)
Двойная связь: σ-связь+π-связь Тип гибридизации: sp²
Валентный угол: 120°
Форма молекулы:
плоскостная (треугольная)
Слайд 8
Получение алкенов
1.Крекинг нефтепродуктов:
СН3 –СН2 –СН2 –СН3 → СН2
= СН2 + СН3 – СН3
2.Дегидрирование алканов:
PtСН3 – СН3 → СН2 = СН2 + Н2
Слайд 9
Получение алкенов
3.Дегидратация спиртов:
4.Дегидрогалогенирование:
H3C-CH2-CH2Br + NaOH(спирт.р-р) → NaBr+ H2O
+ + H3C-CH=CH2
Слайд 11
Физические свойства
Этен,пропен, бутен – газы
С5Н10 – С16Н32
- жидкости
Высшие алкены – тв.вещества
Слайд 12
Химические свойства
I.Реакции присоединения:
1.Гидрирование :
CH2=CH-CH3+Н2 → CH3-CH2-CH3
2.Галогенирование:
CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3
3.Гидрогалогенирование:
CH2=CH-CH3+НCl → CH3-CHCl-CH3
Слайд 14
Химические свойства
II.Реакции окисления:
1.Полное окисление (горение):
С2Н4 + 3О2
→ 2СО2 + 2Н2О
2.Неполное окисление:
3С2Н4 + 2KMnO4 +4Н2О →3HOCH2-CH2OH
++2MnO2 + 2KOH