Слайд 3
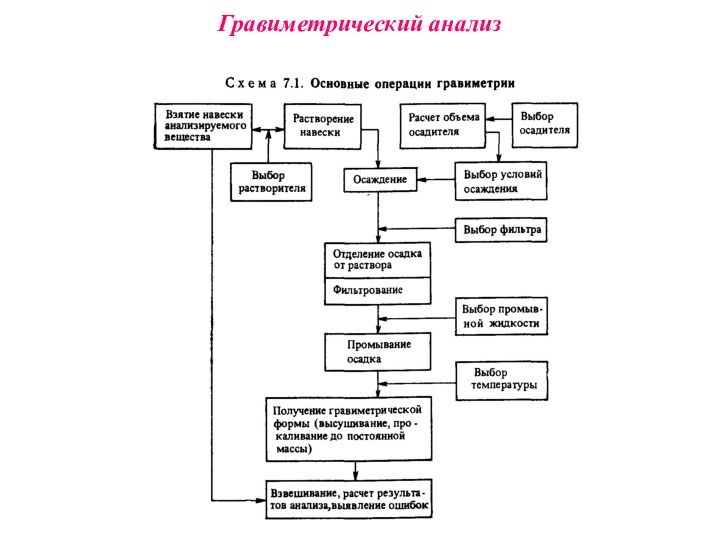
Гравиметрический анализ
Гравиметрией называют метод количественного анализа, заключающийся в
точном измерении массы определяемого компонента пробы, выделенного в виде
соединения известного состава. Предел обнаружения - 0,10%; правильность - 0,2 отн. %.
Наиболее распространен метод осаждения, при котором навеску анализируемого вещества растворяют и прибавляют 1,5-кратный избыток реагента-осадителя, соблюдая необходимые условия осаждения. Полученный осадок называют осаждаемой формой. Соединение, в виде которого определяемый компонент осаждается из раствора, называется формой осаждения. Осадок отделяют от раствора (чаще всего фильтрованием), промывают, затем высушивают или прокаливают, получая гравиметрическую (весовую) форму. Соединение, в виде которого производят взвешивание, называют гравиметрической формой
Слайд 4
Гравиметрический анализ
Массовую долю определяемого компонента рассчитывают по формуле
-
масса высушенного или прокаленного осадка
F – гравиметрический фактор (фактор
пересчета)
а – навеска анализируемого вещества
Слайд 5
Гравиметрический анализ
Требования к реагенту-осадителю
Осадитель должен быть летучим веществом
Выбираемый
осадитель должен обладать селективностью по отношению к определяемому иону.
Требования
к осаждаемой форме
Осаждаемое соединение должно обладать как можно меньшей растворимостью в воде.
Желательно, чтобы структура осадка позволяла достаточно быстро проводить его фильтрование.
Осаждаемая форма должна при прокаливании нацело превращаться в гравиметрическую форму.
Требования к гравиметрической форме
Точное соответствие состава определенной химической формуле, иначе невозможно провести вычисление результатов анализа.
Достаточная химическая устойчивость. Гравиметрическая форма не должна изменять свою массу на воздухе из-за поглощения паров воды и углекислого газа или вследствие частичного разложения.
Для точности определения желательно, чтобы гравиметрическая форма возможно большую молекулярную массу и содержала как можно меньше атомов определяемого элемента в молекуле.
Слайд 6
Титриметрический анализ
Титриметрический анализ основан на точном измерении количества
реактива, израсходованного на реакцию с определяемым веществом.
Кислотно-основное титрование
Комплексонометрическое
титрование
Окислительно-восстановительное титрование
Осадительное титрование
Титрованный, или стандартный, раствор - раствор, концентрация которого известна с высокой точностью. Титрование - прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества. Титрующий раствор часто называют рабочим раствором или титрантом.
Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности.
Слайд 7
Титриметрический анализ
Реакции, применяемые в титриметрии, должны удовлетворять следующим
основным требованиям:
1) реакция должна протекать количественно, т.е. константа равновесия
реакции должна быть достаточно велика;
2) реакция должна протекать с большой скоростью;
3) реакция не должна осложняться протеканием побочных реакций;
4) должен существовать способ определения окончания реакции.
В титриметрии различают
прямое
обратное
косвенное титрование.
Расчет результатов титриметрического анализа основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах:
Методы титрования характеризуются высокой точностью: погрешность определений составляет 0,1 - 0,3%.
Слайд 8
Кислотно-основное титрование
Метод кислотно-основного титрования основан на реакциях взаимодействия

между кислотами и основаниями, то есть на реакции нейтрализации:
Н + + ОН - ↔ Н2О
Наступающий в процессе титрования момент, когда количecтвo стандартного раствора реагента (титранта) становится теоретически строго эквивалентным количеству определяемого вещества согласно определенному уравнению химической реакции, называют точкой эквивалентности.
Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования (ктт).
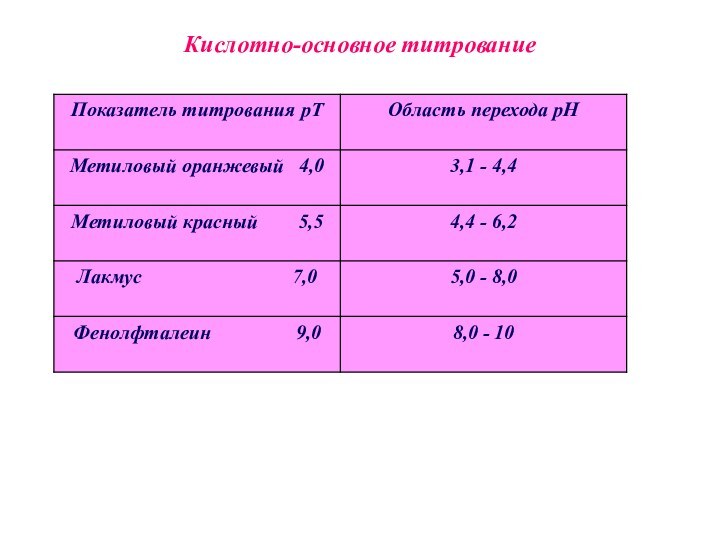
Кислотно-основные индикаторы - это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd ↔ Н++ Ind-
бесцветный малиновый
Величину рН, до которой титруют раствор с данным индикатором, называют показателем титрования этого индикатора - рТ.
Слайд 9
Кислотно-основное титрование
Слайд 10
Комплексонометрическое титрование
Метод анализа, основанный на использовании реакций, сопровождающихся
образованием внутрикомплексных (хелатных) соединений с органическими соединениями - комплексонами.
Комплексонами называют аминополикарбоновые кислоты и их производные.
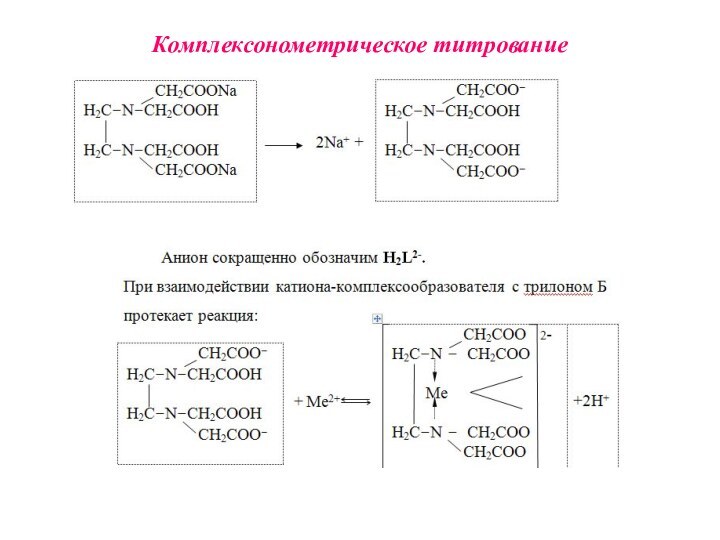
Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), с катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений.
Слайд 11
Комплексонометрическое титрование
Слайд 12
Комплексонометрия
H2L2- + Ме2+ ↔ [MeL]2- + 2Н+
H2L2- +
Ме3+ ↔ [MeL]- + 2Н+
H2L2- + Ме4+ ↔ [MeL]
+ 2Н+
При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
H2Ind- + Ме2+↔ [МеInd]-
(окраска 1) (окраска 2)
[Ме Ind] - + H2L2 - ↔ [MeL]2- + H2Ind-
(окраска 2) (окраска 1)
Слайд 13
Комплексонометрия
Условия комплексонометрическоro титрования:
1. Реакции комплексообразования должны протекать быстро,
количественно и стехиометрично, чтобы вблизи точки эквивалентности определяемые катионы
были практически полностью связаны в комплекс. Константа нестойкости образующихся комплексов должна быть малой величиной.
2. Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б.
3. Комплексонометрическое титрование следует проводить при определенном значении рН (рН < 10), так как в щелочной среде могут образовываться осадки гидроксидов определяемых катионов или их основные соли.
Для поддержания определенного значения рН титрование следует проводить в присутствии буферных растворов, имеющих определенное значение рН. Большинство катионов титруют трилоном Б в присутствии аммиачного буферного раствора NH4ОH + NH4Cl при рН = 9,2.
Слайд 14
Комплексонометрия
Способы комплексонометрического титрования
Прямое титрование. К анализируемому раствору прибавляют

аммиачный буферный раствор, металлоиндикатор и титруют стандартным раствором трилона
Б. Способом прямого титрования определяют катионы Cu2+, Со2+, Pb2+, Ni2+, Zn2+, Fе3+, Ва2+, Сr3+,Ca2+, Mg2+ и т. д.
Обратное титрование. К анализируемому раствору прибавляют аммиачный буферный раствор, затем точно отмеренный удвоенный минимальный объем (35,00-40,00 см3) стандартного раствора трилона Б, который вступает в реакцию с определяемыми ионами, а его избыток оттитровывают стандартным раствором магния сульфата или цинка сульфата в присутствии металлоиндикатора. При этом протекают реакции:
Ме2++ H2L2- ↔ [Ме]2- + 2Н+
изб. H2L2- + Zn2+ ↔ [ZnL]2- + 2Н+
Способ обратного титрования применяют:
1. когда реакция комплексообразования протекает медленно;
2. нет подходящего индикатора для фиксирования конечной точки титрования при прямом способе титрования;
3. индикатор образует с определяемым ионом очень прочный комплекс, который не разрушается комплексоном;
4. для определения катионов в нерастворимых в воде осадках например Са2+ в СаС2О4, Mg2+ в MgNH4PО4, Рb2+ в PbSО4
Слайд 15
Комплексонометрия
Заместительное титрование. Метод основан на том, что большинство
ионов образуют с трилоном Б более устойчивые комплексные соединения,
чем комплекс катионов Mg2+ с трилоном Б [MgL]2- (β = 9,72). После прибавления к анализируемому раствору комплекса [MgL]2- протекает реакция обмена:
[MgL]2- + Ме2+ → [MeL]2- + Mg2+
Эта реакция возможна потому, что ионы металла образуют с H2L2- более прочное комплексное соединение [MeL]2- (β > 9,2), и равновесие вышеприведенной реакции смещается вправо. Выделившиеся ионы Mg2+оттитровывают стандартным раствором трилона Б в присутствии металлохромного индикатора:
Mg2+ + H2L2- → [MgL]2- + 2Н+
Трилонометрическим методом определяют:
а) общую жесткость воды;
б) практически все катионы щелочноземельных и тяжелых металлов;
в) в фармацевтическом анализе - лекарственные формы, содержащие катионы щелочноземельных металлов.
Слайд 16
Окислительно-восстановительное титрование
Методы окислительно-восстановительного титрования основаны на использовании реакций,
связанных с переносом электронов, то есть окислительно-восстановительных процессов.
Окислителем
называется частица (ион, молекула, элемент), которая присоединяет электроны и переходит при этом из более высокой степени окисления в более низкую, т.е. восстанавливается. Восстановитель – это частица, которая отдает электроны и переходит при этом из более низкой степени окисления в более высокую, т.е. окисляется.
2КМnО4 +10FeSО4 +8Н2SО4↔2МnSО4 + 5Fe2(SО4)3+К2SО4 + 8Н2О
Fe2+ - е ↔ Fe3+
МnО4 - + 5е + 8Н + ↔ Мn2+ + 4Н2О
Методы окислительно-восстановительного титрования пригодны для определения многих органических соединений, в том числе фармацевтических препаратов, подавляющее большинство которых являются потенциальными восстановителями.
Слайд 17
Окислительно-восстановительное титрование
В зависимости от используемого титранта различают перманганатометрию,
йодометрию, дихроматометрию, броматометрию. В этих методах в качестве стандартных
растворов применяют соответственно KMnO4, I2, K2Cr2O7, KBrO3 и т.д.
Из всех типов химических реакций, используемых в количественном анализе, окислительно-воостановительные реакции (ОВР) являются наиболее сложными по механизму.
Отличительным признаком ОВР является перенос электронов между реагирующими частицами, в результате чего степень окисления реагирующих частиц изменяется.
Исходная частица и продукт каждой полуреакции составляют ОВ пару. Например, в реакции окисления железа(II) перманганатом калия участвуют две ОВ пары: Fe3+/Fe2+ и MnO4-/Mn2+.
Равновесный потенциал ОВ полуреакции aOx1 + nе = bRed1 может быть рассчитан по уравнению Нернста:
Слайд 18
Окислительно-восстановительное титрование
Окислительно-восстановительные реакции (ОВР) протекают сложнее, чем ионообменные
и имеют следующие особенности:
1. Потенциал системы зависит от величины
стандартного ОВ потенциала системы, концентраций окислителя и восстановителя, концентрации ионов водорода и от температуры.
2. Реакции часто проходят в несколько стадий, причем каждая из них протекает с различной скоростью.
3. Скорость ОВР ниже скорости реакций ионного обмена. Часто требуются особые условия, обеспечивающие протекание реакций до конца.
4. Присутствие осадителей или комплексообразователей, вызывая изменение концентраций окисленной или восстановленной форм, приводит к изменению ОВ потенциала системы.
Слайд 19
Окислительно-восстановительное титрование
Точку эквивалентности фиксируют чаще всего с помощью
Red/Ox – индикаторов, т.е. органических соединений, которые изменяют свою
окраску в зависимости от потенциала системы.
К таким индикаторам относят дифениламин (в окисленном состоянии сине-фиолетовый, а в восстановленном – бесцветный) и N-фенилантраниловая кислота (окисленная форма – красная, восстановленная – бесцветная).
Для некоторых реакций используют специфические индикаторы – вещества, изменяющиеся окраску при реакции с одним из компонентов титрования. Например, таким индикатором является крахмал, образующий с йодом адсорбционное соединение синего цвета.
В некоторых случаях используют титрование без индикатора, если окраска титранта достаточно яркая и резко изменяется в результате реакции. Примером может служить титрование с помощью перманганата калия (KMnO4).








![Количественный анализ КомплексонометрияH2L2- + Ме2+ ↔ [MeL]2- + 2Н+H2L2- + Ме3+ ↔ [MeL]- +](/img/tmb/12/1137298/1fac66cf3ec5d9d1ec78cc574fcc9438-720x.jpg)





































