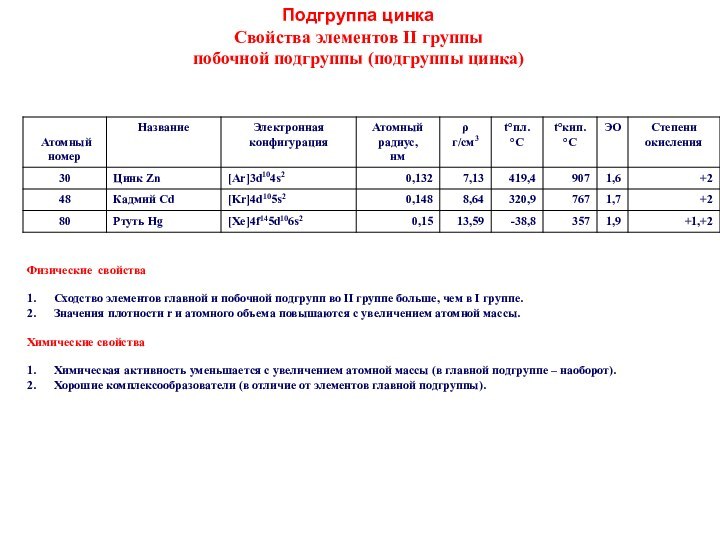
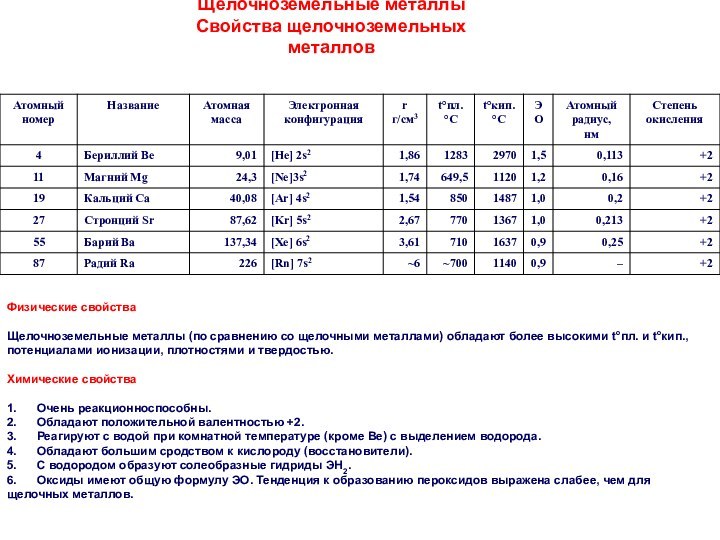
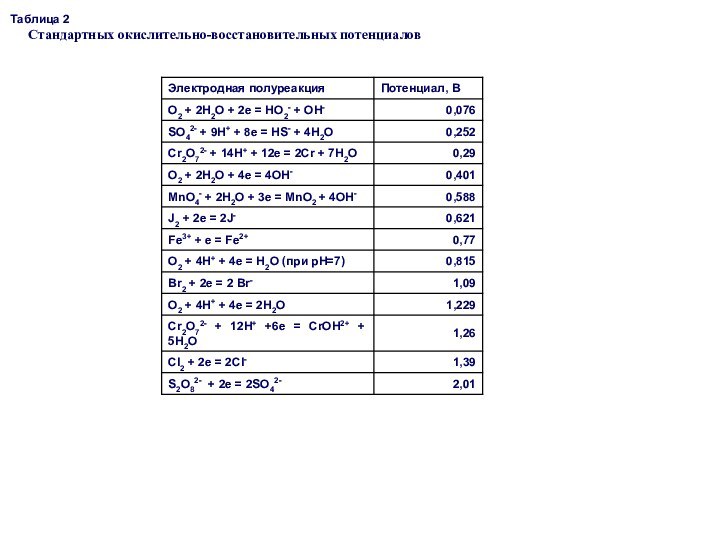
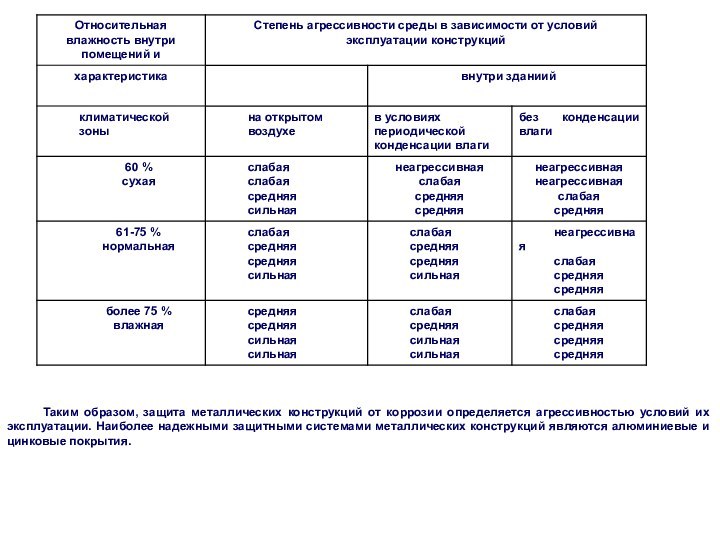
Простые вещества. Молекулы
состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с
образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Неорганические вещества
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Классификация неорганических соединений
Аллотропия
Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С - алмаз, графит, карбин.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
1) различным числом атомов в молекуле, например кислород O2 и озон O3
2) образованием различных кристаллических форм, например алмаз и графит.
Слайд 4
основания
Основания - сложные вещества, в которых атомы металлов
соединены с одной или несколькими гидроксильными группами (с точки
зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Классификация оснований. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Получение оснований:
1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O = Ba(OH)2
3. Электролиз водных растворов солей:
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Слайд 6
ОКСИДЫ
Классификация
Оксиды - это сложные вещества, состоящие из двух
элементов, один из которых кислород
ОКСИДЫ
Несолеобразующие Амфотерные
CO, N2O, NO Al2O3, ZnO, Cr2O3, SnO
Солеобразующие
Основные Кислотные
Na2O; MgO; CuO SO2; SO3; P2O5; Mn2O7; CrO3
Основные оксиды--это оксиды металлов, в которых последние проявляют
небольшую степень окисления +1, +2 ( Na2O; MgO; CuO).
Основным оксидам соответствуют основания,
Кислотны оксиды - это оксиды неметаллов и металлов со степенью окисления от +5 до +7 (SO2; SO3; P2O5; Mn2O7; CrO3).
Кислотным оксидам соответствуют кислоты
Амфотерным оксидам (Al2O3, ZnO, Cr2O3, SnO) соответствуют и основания и кислоты
Слайд 7
Получение Оксидов
1. Взаимодействие простых и сложных веществ с
кислородом:
2Mg + O2 = 2MgO
4P + 5O2
= 2P2O5
S + O2 = SO2
2CO + O2 = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
CH4 + 2O2 = CO2 + 2H2O
4NH3 + 5O2 кат 4NO + 6H2O
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 t= CuO + H2O
(CuOH)2CO3 t= 2CuO + CO2 + H2O
2Pb(NO3)2 t= 2PbO + 4NO2 + O2
2HMnO4 H2SO4 (конц), t Mn2O7 + H2O
Слайд 8
Химические свойства оксидов
Слайд 9
Кислоты - сложные вещества, состоящие из
атомов водорода и кислотного остатка. (С точки зрения теории
электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Классификация кислот
1.По составу: бескислородные и кислородсодержащие.
2. По числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные...
кислоты
Слайд 10
Получение Кислот
1.Взаимодействие кислотного
оксида с водой (для кислородсодержащих кислот):
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 = 2HCl
H2 + S = H2S
3. Реакциями обмена соли с кислотой Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей
более сильными кислотами:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
2NaCl (тв.) + H2SO4 (конц.) t Na2SO4 + 2HCl
Слайд 11
Химические Свойства Кислот
1.Действие на индикаторы.
лакмус - красный
метилоранж - розовый
2. Взаимодействие с основаниями (реакция нейтрализации):
H2SO4 + 2KOH = K2SO4 + 2H2O
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
3. Взаимодействие с основными оксидами:
CuO + 2HNO 3 t Cu(NO3)2 + H2O
4. Взаимодействие с металлами:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители).
5. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок:
H2SO4 + BaCl2 = BaSO4↓ +2HCl
2HCl + K2CO3 = 2KCl + H2O + CO2
Слайд 12
Соли - сложные вещества, которые состоят из атомов
металла и кислотных остатков. Это наиболее многочисленный класс неорганических
соединений.
Классификация солей
соли
Средние Кислые
Двойные Смешанные
Основные Комплексные
соли
Слайд 13
Средние – при диссоциации дают катионы металла (или
NH4+) и анионы кислотного остатка.
Na2SO4 = 2Na+ +SO42-
CaCl2 =
Ca2+ + 2Cl-
Кислые - при диссоциации дают катионы металла (или NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 = Na+ + HCO3- = Na+ + H+ + CO32-
Продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла.
Основные - при диссоциации дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl = [Zn(OH)]+ + Cl- = Zn2+ + OH- + Cl-
Продукты неполного замещения групп OH- соответствующего основания на кислотные остатки.
Двойные - при диссоциации дают два катиона и один анион.
KAl(SO4)2 = K+ + Al3+ + 2SO42-
Смешанные - образованы одним катионом и двумя анионами:
CaOCl2 = Ca2+ + Cl- + OCl-
Комплексные - содержат сложные катионы или анионы.
[Ag(NH3)2]Br = [Ag(NH3)2]+ + Br -
Na[Ag(CN)2] = Na+ + [Ag(CN)2]-
Слайд 14
Средние Соли
Получение
Большинство способов получения солей основано на взаимодействии
веществ с противоположными свойствами:
1) металла с неметаллом:
2Na + Cl2 = 2NaCl
2) металла с кислотой:
Zn + 2HCl = ZnCl2 + H2
3) металла с раствором соли менее активного металла
Fe + CuSO4 = FeSO4 + Cu
4) основного оксида с кислотным оксидом:
MgO + CO2 = MgCO3
5) основного оксида с кислотой
CuO + H2SO4 = CuSO4 + H2O
6) основания с кислотным оксидом
Ba(OH)2 + CO2 = BaCO3 + H2O
7) основания с кислотой:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
8) соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
9) раствора основания с раствором соли:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓
10) растворов двух солей:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
Слайд 15
Химические Свойства Солей
1. термическое разложение солей:
CaCO3
= CaO + CO2
2 Cu(NO3)2 = 2CuO + 4NO2 + O2
NH4Cl = NH3 + HCl
2. гидролиз солей:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S
FeCl3 + H2O = Fe(OH)Cl2 + HCl
Na2S + H2O = NaHS +NaOH
3. обменные реакции с кислотами, основаниями и другими солями:
AgNO3 + HCl = AgCl ↓ + HNO3
Fe(NO3)3 + 3NaOH = Fe(OH)3 ↓ + 3NaNO3
CaCl2 + Na2SiO3 = CaSiO3 ↓ + 2NaCl
4. окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Слайд 16
Кислые Соли
Получение
1. Взаимодействие кислоты с недостатком основания.
KOH + H2SO4 = KHSO4 +
H2O
2. Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3. Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Химические свойства.
1. Термическое разложение с образованием средней соли
Ca(HCO3)2 → CaCO3 ↓ + CO2↑+ H2O
2. Взаимодействие со щёлочью. Получение средней соли
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Основные Соли
Получение
1. Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3↓ + CO2 + 4NaCl
Химические свойства.
1. Термическое разложение.
[Cu(OH)]2CO3(малахит) = 2CuO + CO2 + H2O
2. Взаимодействие с кислотой: образование средней соли.
Sn(OH)Cl + HCl = SnCl2 + H2O
Слайд 18
Комплексные соли
![Химия Комплексные соли СтроениеK4[Fe(CN)6]Внешняя сфера 4K+](/img/tmb/11/1077522/7f496e1e90825f9d0f0ec245a14fe6cf-720x.jpg)
Строение
K4[Fe(CN)6]
Внешняя сфера
4K+
Внутренняя сфера [Fe(CN)6]4-
Комплексообразователь (центральный атом) Fe2+
Координационное число – число лигандов 6
Лиганды CN-
Центральными атомами обычно служат ионы металлов больших периодов (Co, Ni, Pt, Hg, Ag, Cu т.д., которые содержат свободные орбитали ); типичными лигандами являются OH-, CN-, H2O, CI-, Br-,I-, NO2- и др., нейтральные вещества NH3, CO и др.которые содержат в своём составе атомы с неподелёнными электронами. Центральный атом и лиганды связаны донорно-акцепторным механизмом ковалентной связью (смотри далее в разделе «Комплексные соединения»).
Получение
1. Реакции солей с NH3 : AgCl + 2NH3 = [Ag(NH3)2]Cl
2. Ракции соли с солью: FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Химические свойства.
1. Разрушение комплексов за счёт образования малорастворимых соединений:
2[Cu(NH3)2]Cl + K2S = CuS↓ + 2KCl + 4NH3
2. Обмен лигандами между внешней и внутренней сферами.
K2[CoCl4] + 6H2O = [Co(H2O)6]Cl2 + 2KCl
(Смотри далее тему комплексные соединения)
Слайд 19
ГЕНЕТИЧЕСКАЯ СВЯЗЬ
МЕЖДУ РАЗЛИЧНЫМИ КЛАССАМИ СОЕДИНЕНИЙ
Примеры
1. Металл
+ неметалл ═ соль
Hg + S ═ HgS
2Al + 3I2 ═ 2AlI3
2. Основной оксид + кислотный оксид = соль
Li2O + CO2 = Li2CO3
CaO + SiO2 = CaSiO3
3. Основание + кислота = соль
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
4. Металл + кислород = основной оксид
2Ca + O2 = 2CaO
4Li + O2 = 2Li2O
5. Неметалл + кислород = кислотный оксид
S + O2 = SO2
4As + 5O2 = 2As2O5
6. Основной оксид + вода = основание
BaO + H2O = Ba(OH)2
Li2O + H2O = 2LiOH
7. Кислотный оксид + вода = кислота
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Слайд 20
АТОМНО- МОЛЕКУЛЯРНОЕ УЧЕНИ
Закон Авогадро (А.

Авогадро, 1811)
В равных объемах газов (V) при одинаковых условиях
(температуре Т и давлении Р) содержится одинаковое число молекул.
Следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности, при нормальных условиях, т.е. при 0° С (273К) и
101,3 кПа, объем 1 моля газа, равен 22,4 л. Этот объем называют молярным объемом газа Vm.
Таким образом, при нормальных условиях (н.у.) молярный объем любого газа Vm = 22,4 л/моль.
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным используется объединенный газовый закон Бойля-Мариотта и Гей-Люссака:
где Рo, Vo, Тo - давление, объем газа и температура при нормальных условиях (Рo = 101,3 кПа, Тo = 273К).
Если известна масса (m) или количество (n) газа и требуется вычислить его объем, или наоборот, используют
уравнение Менделеева - Клапейрона:
PV = n RT, где n = m/M - отношение массы вещества к его молярной массе,
R - универсальная газовая постоянная, равная 8,31 Дж/(мольЧК).
Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
где М1 и М2 - молярные массы двух газообразных веществ. Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:
M1 = D Ч M2.
Слайд 21
Закон постоянства состава (Ж. Пруст, 1808)
Все

индивидуальные вещества имеют постоянный качественный и количественный состав независимо
от способа их получения.
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения. Наряду с веществами, имеющими постоянный состав, существуют вещества переменного состава. К ним относятся соединения, в которых чередование нераздельных структурных единиц (атомов, ионов) осуществляется с нарушением периодичности.
В связи с наличием соединений переменного состава современная формулировка закона постоянства состава содержит уточнения:
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.
Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.

Закон сохранения массы (М.В.
Ломоносов, 1748)
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии.
На основании этого закона химические реакции можно отобразить с помощью химических уравнений, используя
химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число
молей) участвующих в реакции веществ.
Например, реакция горения метана записывается следующим образом:
На основании химических уравнений проводятся стехиометрические расчеты. ля измерения масс атомов и молекул в физике и химии принята единая система измерения. Эти величины измеряются в относительных единицах.
Атомная единица массы (а.е.м.) равна 1/12 массы m атома углерода 12С (m одного атома 12С равна 1,993Ч10-26кг).
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины Ar определяют по таблице Д.И. Менделеева
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м. Например, для атома водорода абсолютная масса определяется следующим образом:
m (H) = 1,008Ч1∙ 661Ч10-27 кг = 1,674Ч10-27 кг
Относительная молекулярная масса соединения (M r) – это безразмерная величина, равная отношению массы m молекулы вещества к 1/12 массы атома 12С:
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы. Например:
М r (C2H6) = 2Ч A r (C) + 6ЧA r (H) = 2Ч12 + 6 = 30.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.м.
Слайд 23
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы

– молекулы, атомы, ионы, электроны. Число таких частиц даже
в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль - это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро (NA= 6,02Ч1023 моль-1).
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 Ч 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей n (ню). Например, в образце вещества содержится 12,04 Ч 1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N - число частиц данного вещества;
NA - число частиц в одном моле вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса одного моля этого вещества.
По величине она равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Молярная масса имеет размерность г/моль. Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
Слайд 24
M(CH4)=16 г/моль, т.е. 16г CH4 содержат 6,02Ч1023 молекул.

Молярную массу вещества можно вычислить, если известны его масса
m и количество (число молей) n, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
m = n Ч M .
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример:
Вычислить массы метана CH4 и этана С2H6, взятых в количестве
n = 2 моль каждого.
Решение:
Молярная масса метана равна 16 г/моль, а этана С2Н6 – 30 г/моль. Отсюда:
m(CH4) = 2 моль Ч 16 г/моль = 32 г;
m(С2Н6) = 2 моль Ч 30 г/моль = 60 г.
Таким образом, моль - это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(CH4) = n(С2Н6), но m(CH4) < m(С2Н6)
Вычисление n используется практически в каждой расчетной задаче.
Слайд 25
Эквивалент элемента, эквивалент соединения, молярная масса эквивалента вещества.

В 1792г.В.Рихтером сформулирован закон эквивалентов: химические вещества взаимодействуют друг
с другом в количествах, пропорциональным их эквивалентам.
Эквивалентом вещества (ЭА) называют такую его формульную единицу (часть атома, молекулы, иона), которая равноценна по своему действию одному атому водорода в данной реакции обмена или одному электрону в окислительно - восстановительной реакции.
Э = 1/Z A, где: Э – эквивалент
1/Z – фактор эквивалентности
fэкв = 1/Z , Z – число эквивалентности
A – вещество (формула)
Фактор эквивалентности (f (A )– число, равное той доле частицы А, которая является эквивалентом вещества в данной реакции.
ЭH2SO4 = 1/2 H2SO4; fэкв = 1/2
ЭCa = 1/2 Ca; fэкв = 1/2;
Z – валентность элемента.
Пользуясь понятием «моль» как единицей количества вещества, можно дать следующее определение химического эквивалента вещества:
Эквивалент элемента – это такое его количество, которое соединяется с одним моль атомов водорода или замещает то же количество атомов водорода в соединениях.
Эквивалентом соединения называется определенное количество сложного вещества, которое полностью взаимодействует с одним эквивалентом водорода или другого вещества.
HCl ЭCl = 1/1Cl fэкв(Cl) = 1/1
H2O ЭO = 1/2 O fэкв(O) = 1/2
NH3 ЭN = 1/3N fэкв(N) = 1/3
CH4 ЭС = 1/4С fэкв(С) = 1/4
Фактор эквивалентности простого вещества определяется валентностью элемента.
ЭAl = 1/3 Al fэкв = 1/3
ЭС = 1/4С fэкв = 1/3
Фактор эквивалентности сложных веществ определяется числом замещенных
Слайд 26
Кислота.
fэкв H2SO4 =
1/2
fэкв H3PO4 = 1/3
ЭH2SO4 = 1/2 H2SO4 ЭH3PO4 = 1/3 H3PO4
Основаниe.
fэкв NaOH = 1/1 fэкв Ca(OH)2 = 1/2
ЭNaOH = 1/1 NaOH ЭCa(OH)2 = 1/2 Ca(OH)2
Соль.
fэкв (Al2(SO4)3 = 1/6 fэкв Ca3(PO4)2 = 1/6
Z = n ∙ m.
где:n – валентность металла m – число атомов металла
Оксиды.
fэкв P2O5 = 1/10 fэкв SiO2 = 1/4
ЭP2O5 = 1/10 P2O5 ЭSiO2 = 1/4 SiO2
Молярная масса эквивалента вещества М(fэквА) или Мэ(А) – это масса одного эквивалента вещества и равна произведению фактора эквивалентности умноженному на молярную массу вещества.
Мэ(А) = 1/z ∙ М(А)г/моль или М(1/Z А) = 1/Z∙ М(А)
М(1/Z Fe) = 1/Z ∙ M(Fe) М(1/Z Н2SO4) = 1/Z ∙ M(H2SO4)
М(1/3 Fe) = 1/3 ∙ 56 = 18.7 г/моль М(1/2 Н2SO4) = 1/2 ∙ 98 = 49 г/моль
Эквивалент, фактор эквивалентности и молярная масса эквивалента вещества не являются величиной постоянной и определяются количеством замещенных частиц в данной реакции.
Слайд 27
Например:
1. H3PO4 + NaOH NaH2PO4 + H2O
в

реакции замещается один атом водорода
ЭH3PO4 = 1/1 H3PO4;
MЭ(H3PO4) = 1/1 ∙ M(H3PO4)
2. H3PO4 + 2NaOH Na2HPO4 + 2H2O
в реакции замещается два атома водорода
ЭH3PO4 = 1/2 H3PO4 ; MЭ(H3PO4) = 1/2 ∙ M(H3PO4)
3. H3PO4 + 3NaOH Na3PO4 + 3H2O
в реакции замещается три атома водорода
ЭH3PO4 = 1/3 H3PO4; MЭ(H3PO4) = 1/3 ∙ M(H3PO4)
В окислительно-восстановительных реакциях эквивалент, фактор эквивалентности определяется числом отданных или присоединенных электронов в данной реакции.
Например:
2KMnO4+ 5Na2SO3 + 3H2SO4 2MnSO4 + 5Na2SO4 + К2SO4+3H2O
ЭKMnO4 = 1/5 KMnO4 ; MЭ(KMnO4) = 1/5 ∙ M(KMnO4), т.к.
Mn+7 + 5е‾ Mn+2 или MnO-4 + 8H+ + 5е‾ Mn+2 + 4H2O
В случае кислых или основных солей значение эквивалента зависит от характера протекания реакции.
Например:
KHSO4+ KOHK2SO4 + H2O.
Для нейтрализации 1 моль KHSO4 нужно взять 1 моль KOH. Следовательно:
ЭKHSO4 = 1, а М (1/Z KHSO4) = 1/1 ∙ 136 = 136 г/моль.
FeOHCl2 + 2AgNO3 2AgCl + FeOH(NO3)2
Э = 1/2 FeOHCl2 М (1/z FeOHCl2) = 74 г/моль.
FeOHCl2 + HCl FeCl3 + H2O
Э = 1/1 FeOHCl2.
Слайд 28
В реакции обмена:
KCr(SO4)2 + 3KOH Cr(OH)3 +
2K2SO4
каждая молекула соли участвует тремя единицами степени окисления хрома,
т.е. от соли в обмене участвует только хром, поэтому молярная масса эквивалента соли выражается формулой:
М(1/Z KCr (SO4)2) = /3 ∙ M(KCr(SO4)2) = = 94,7 г/моль.
Эквивалент и его молярная масса могут быть найдены на основании закона эквивалентов, согласно которому реакция между веществами протекает как взаимодействие между их эквивалентами.
Так в реакции: KAl(SO4)2 + 4KOH KAlO2 + 2K2SO4 + 2H2O
на один эквивалент KOH приходится 1/4 часть двойной соли. Тогда
Э = 1/4 KAl(SO4)2
М(1/Z KAl(SO4)2) = 1/4∙ М(KAl(SO4)2) == 64,5 г/моль.
Итак, молярная масса эквивалента вещества в реакциях обмена и замещения равна молярной массе этого вещества, деленной на число замещенных частиц.
Пользуясь понятием молярной массы эквивалента вещества, можно сформулировать закон эквивалентов:
Массы реагирующих вещества пропорциональны молярным массам эквивалентов этих веществ
Слайд 29
Все в окружающем нас мире состоит

из крошечных частиц, которые называются атомами. Человеку трудно себе
представить, насколько они малы. Например, длина цепи, составленной из 100млн атомов, равна 1см. А цепь из 1млн атомов будет равна толщине одной странице книги. Элементарные частицы
Атомы состоят из еще более мелких частиц, называемых элементарными частицами. В центре каждого атома есть ядро. Ядро содержит два вида элементарных частиц, которые называются протонами и нейтронами. Существует еще один, третий вид элементарных частиц. Эти частицы наз. электронами. Они не входят в состав ядра атома, а движутся вокруг него. Электроны находятся на разных энергетических уровнях, которые называются оболочками. Каждая оболочка содержит определенное количество электронов. Когда одна оболочка заполняется электронами до предела, у атома образуется новая оболочка. Современные ученые считают, что протоны и нейтроны, в свою очередь, состоят из еще более мелких
частиц, которые называются кварками.
Строение атома
Электрический заряд
Элементарные частицы, из которых состоит атом, удерживаются вместе электрическим зарядом. Заряд бывает положительным и отрицательным. Элементарные частицы с противоположными электрическими зарядами
притягиваются друг к другу. Протоны имеют положительный электрический заряд, а электроны отрицательный. Нейтроны не имеют электрического
заряда, они нейтральны.
Ядро атома
Ядро атома состоит из протонов и нейтронов (общее название - нуклоны). Число протонов в ядре атома элемента строго определено - равно порядковому номеру элемента в периодической системе - Z. Число нейтронов в ядре атомов одного и того же элемента может быть различным - A - Z (где А - относительная атомная масса элемента; Z - порядковый номер).
Заряд ядра атома определяется числом протонов. Масса ядра определяется
суммой протонов и нейтронов.
Слайд 30
Изотопы
Изотопы - разновидности атомов определенного химического
элемента, имеющие одинаковый атомный номер, но разные массовые числа.
Обладают ядрами с одинаковым числом протонов и различным числом нейтронов, имеют одинаковое строение электронных оболочек и занимают одно и то же место в периодической системе химических элементов.
Относительные атомные массы элементов, приводимые в периодической системе - есть средние массовые числа природных смесей изотопов. Поэтому
они и отличаются от целочисленных значений.
Пример.
Природный таллий (ат.н.81, ат. масса 204,383) состоит из двух изотопов:
таллий – 203 таллий - 205
Средняя атомная масса таллия равна:
Aср.(Tl) = (0,295 • 203 + 0,705 • 205) / 2 = 204,383
Изотопы водорода имеют специальные символы и названия:
Химические свойства изотопов одного элемента одинаковы. Изотопы, имеющие одинаковые массовые числа, но различные заряды ядер, называются изобарами
Слайд 31
Радиоактивность
Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного химического

элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц
или ядер (например, α-частиц).
Радиоактивность, проявляемая природными изотопами элементов,
называется естественной радиоактивностью.
Самопроизвольный распад ядер описывается уравнением: mt = m0 • (1/2)t / T 1/2
где mt и m0 - массы изотопа в момент времени t и в начальный момент времени; Т1/2 - период полураспада, который является постоянным для данного изотопа. За время Т1/2 распадается половина всех ядер данного изотопа.
Основные виды радиоактивного распада.
α - распад. Сопровождается потоком положительно заряженных ядер атома гелия 42Не (α- частиц) со скоростью 20000 км/с. При этом заряд Z исходного ядра уменьшается на 2 единицы (в единицах элементарного заряда), а массовое число А - на 4 единицы (в атомных единицах массы).
Z' = Z – 2
A' = A – 4
т.е. образуется атом элемента, смещенного по периодической системе на две клетки влево, от исходного радиоактивного элемента, а его массовое число на 4 единицы меньше исходного.
β - распад. Излучение ядром атома потока электронов со скоростью 100'000 - 300'000 км/с. (Электрон образуется при распаде нейтрона ядра. Нейтрон может распадаться на протон и электрон.) При β- распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1. (Химический элемент смещается в периодической системе на одну клетку вправо, а его массовое число не изменяется)
Слайд 32
γ- - распад. Возбужденное ядро испускает электромагнитное излучение

с очень малой длиной волны и высокой частотой, обладающее
большой проникающей способностью, при этом энергия ядра уменьшается, массовое число и заряд остаются неизменными. (Химический элемент не смещается в периодической системе, его массовое число не изменяется и лишь ядро его атома переходит из возбужденного состояния в менее возбужденное).
Ядерные реакции - превращения ядер, происходящие при их столкновении друг с другом или с элементарными частицами. Первая искусственная ядерная реакция была осуществлена Э.Резерфордом (1919 г.) при бомбардировке ядер азота β- частицами:
С помощью ядерных реакций были получены изотопы многих химических элементов и ядра всех химических элементов с порядковыми номерами от 93 до 110.
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства.
Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь только строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня.
Пример 1. Изотоп 101-го элемента – менделевия (256) был получен бомбардировкой α-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение. Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других. Превращения атомных ядер, как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) частиц в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением:
253/99Es + 4/2He = 256/101Md + 1/0n
Часто применяют сокращенную форму записи. Для приведенной реакции она имеет вид: 253Es(a, n)256Md.
В скобках на первом месте пишут бомбардирующую частицу, а на втором, через запятую, частицу, образующуюся при данном процессе. В сокращенных уравнениях частицы 4/2He; 1/1H; 2/1D; 1/0n обозначают соответственно а, p, d, n.
Слайд 33
Пример 2. Исходя из сокращенных уравнений ядерных реакций
(табл.)
напишите их полные уравнения.
Решение. Ответ на
вопрос отражен в таблице
Сокращённые и полные уравнения ядерных реакций
Слайд 34
Поведение электрона в атоме
Квантовые числа
Состояние каждого электрона

в атоме обычно описывают с помощью четырех квантовых чисел:
главного (n), орбитального (ℓ), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве,
а четвертое - вокруг собственной оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Пример.
Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3,
n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное квантовое число (ℓ).
Характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c
одинаковыми n и ℓ - подуровнем.
Для
ℓ=0 s- подуровень, s- орбиталь – орбиталь сфера
ℓ=1 p- подуровень, p- орбиталь – орбиталь гантель
ℓ=2 d- подуровень, d- орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы
Слайд 35
На первом энергетическом уровне (n = 1) орбитальное

квантовое число ℓ принимает энергетическом только один подуровень -
1s. Для второго энергетического уровня (n = 2) квантовое единственное значение
ℓ = (n - 1) = 0. Форма обитали - сферическая; на первом орбитальное число может принимать два значения: ℓ = 0, s- орбиталь - сфера большего размера, чем на первом энергетическом уровне; ℓ = 1, p- орбиталь - гантель. Таким образом, на втором энергетическом уровне имеются два подуровня - 2s и 2p. Для третьего энергетического уровня (n = 3) орбитальное квантовое число ℓ принимает три значения: ℓ = 0, s- орбиталь - сфера большего размера, чем на втором энергетическом уровне; ℓ = 1, p- орбиталь - гантель большего размера, чем на втором энергетическом уровне; ℓ = 2, d- орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть три
энергетических подуровня - 3s, 3p и 3d.
Магнитное квантовое число (m). Заполнение атомных орбиталей электронами характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -ℓ до +ℓ, включая 0. Это означает, что для каждой формы орбитали существует (2ℓ + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (ℓ = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве.
Для p- орбитали (ℓ = 1) - три равноценные ориентации в пространстве
(2ℓ + 1 = 3): m = -1, 0, +1.
Для d- орбитали (ℓ = 2) - пять равноценных ориентаций в пространстве
(2ℓ + 1 = 5): m = -2, -1, 0, +1, +2.
Таким образом, на s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f- подуровне - 7 орбиталей.
Спиновое квантовое число (s) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения.
При заполнении атомных орбиталей электронами соблюдаются четыре основные правила.
1.Принцип устойчивости. АО заполняются электронами в порядке повышения их энергетических уровней:
1s < 2s < 2p < 3s < 3p < 4s < 3d ...
2. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, ℓ, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами).
3. Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня или на АО с одинаковой энергией, так называемых вырожденных орбиталях, электроны располагаются по одному с параллельными спинами.
Слайд 36
4. Правило Клечковского (принцип наименьшей энергии). В

основном состоянии аждый электрон располагается так, чтобы его энергия
была минимальной. Чем меньше сумма (n + ℓ), тем меньше энергия орбитали. При заданном значении (n + ℓ) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией этого атома. В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых:
1) Главное квантовое число n минимально;
2) Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d- ℓ минимально;
3) Заполнение происходит так, чтобы (n + ℓ) было минимально (правило Клечковского);
4) В пределах одного подуровня электроны располагаются таким образом, чтобы их суммарный спин был максимален, т.е. содержал наибольшее число неспаренных электронов (правило Хунда).
5) При заполнении электронных атомных орбиталей выполняется принцип Паули. Его следствием является, что энергетическому уровню с номером n может принадлежать не более чем 2n2 электронов, расположенных на n2 подуровнях.
Слайд 37
Электронные конфигурации
В химических превращениях принимают участие электроны
внешнего электронного уровня - валентные электроны. Наиболее распространенные в
органических соединениях элементы (элементы-органогены) относятся в основном ко 2-му (С, N, O) и 3-му (P, S, Cl) периодам Периодической системы. Валентными электронами этих элементов являются 2s-, 2р- и 3s-, 3р-электроны, соответственно.
Валентные электроны элементов-органогенов
Слайд 38
Пример 1. Написать электронную формулу цезия

(Сs).
Решение. Цезий (Сs) находится
в 6 периоде, его 55 электронов (порядковый номер 55) распределены по 6 энергетическим уровням и их подуровням. Cоблюдая последовательность заполнения электронами орбиталей получим:
55Cs 1s2 2s2 2p6 3s2 3p6 4s23d10 4p6 5s2 4d10 5p6 6s1
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 25. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов n
где n - главное квантовое число,
L-орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение - s, p, d, f), x - число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией - меньшая сумма n +L
(правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d¹)→4f→5d2…→6p→7s→6d¹→5f →6d2..→7p
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов № 17 (хлор) и № 25 (марганец) электронные формулы имеют вид:
17CI - 1s2 2s2 2p6 3s2 3p5
25Mn - 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Распределение электронов по квантовым уровням
Слайд 40
Электронная структура атома может быть изображена также
в виде схем размещения электронов в квантовых (энергетических) ячейках,
которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника , кружка Ο или линейки — , а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами
, или
.
В данном пособии применяют прямоугольники. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
s
17CI
25Mn
s
Слайд 41
ПЕРИОДИЧЕСКИЙ ЗАКОН
XIX век. Растет количество открытых химических элементов,

определяются их атомные массы, изучаются химические свойства. Систематизация растущего
фактического материала становилась актуальной задачей. Делалось много попыток создать некую систему элементов, расположив их по возрастанию атомных масс и разделив на колонки. Деберейнер (1829) делил элементы на триады - Ма(среднего члена)≈[Ма(кон)-Ма(нач)]/2. Ньюлендс делил на октавы. В 1864 г. Мейер опубликовал таблицу, в которой 44 из известных тогда 63 элементов были расположены в порядке возрастания атомных масс в шести столбцах в соответствии с их высшей валентностью по водороду.
Д.И.Менделеев (1870) сформулировал открытый им закон следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от их атомного веса»
Заслуги Д.И.Менделеева.
1. Он рассматривал периодичность не одного какого-либо свойства, а всех свойств - химических и физических (в отличие от предшественников).
2. Он ввел длинные ряды и периоды - таблица не представляет собой аккуратного прямоугольника, что предусматривает возможности дальнейшего развития. 1895 - открыты инертные газы.
3. Он оставил пустые клетки в таблице, которые позднее были заполнены вновь открытыми элементами, причем их свойства с большой точностью совпадают с предсказанными Д.И.Менделеевым.
Экабор - скандий , 1879, Нильсен
Экаалюминий - 1875, галлий, Лекок де Буабодран
Экасилиций - 1885, германий, Винклер
4. Исправил атомные веса некоторых элементов, что потом было подтверждено экспериментально (Cr, In, Pt, Au, U)
5. Переставил некоторые элементы местами вопреки некоторой немонотонности в изменении атомных масс (никто еще не подозревал тогда о существовании изотопов). Te (127.60) он поставил перед иодом (126.90). А открытый гораздо позднее аргон (39.94) поставил в группу инертных газов перед калием (39.1).
В определении свойств Д.И.Менделеев пользовался правилом среднего арифметического. Например: какие свойства должен иметь H2S?
H2O
PH3 H2S HCl
H2Se
Находясь между сильной кислотой HCl и РH3, который ни основных ни кислотных свойств практически не проявляет, и между амфотерной водой и довольно сильной кислотой H2Se он должен быть слабой кислотой.
Самое удивительное, что через много лет (1913) Мозли по данным характеристического рентгеновского излучения установил, что число положительных зарядов в ядре атома равно его порядковому номеру в таблице Д.И.Менделеева.

формулировка периодического закона:
Физические и химические свойства простых веществ, а
также формы и свойства сложных соединений находятся в периодической зависимости от величины заряда ядра атома.
Какие, конкретно, свойства . Все. Для атомов - атомный радиус и объем, ионный радиус, ионизационный потенциал, Электроотрицательность, степени окисления… Для простых веществ и соединений (физ.) ковкость, твердость, коэффициент расширения, преломления, плотность; (хим.) металл - неметалл, формулы оксидов, гидридов, галогенидов; реакционная способность, теплоты образования соединений, сольватации и т.д. Но, наверное, главное, что стало известно сравнительно недавно - это мы можем на основании квантового подхода к строению атома и зная заряды атомов построить Периодическую таблицу, не глядя в учебник, и при этом получим все то, что предсказал Менделеев.
Возьмем 1H - 1e-, электронная конфигурация 1s1; следующий атом 2Не- 2e-, электронная конфигурация 1s2. Уровень с главным квантовым числом 1 заполнен, надо заполнять следующий слой с n = 2, т.е. начинать новый период.
Во втором периоде заполняем 2s и 2p орбитали, их четыре, их емкость 8e-. Во втором периоде как раз восемь элементов. Начинаем следующий, третий период – n = 3. Na:[Ne] 3s1, Ar:[Ne] 3s23p6. Далее по правилу Клячковского мы должны заполнять не 3d, а 4s уровень, т.е. начинать новый период. K:[Ar] 4s1, Ca:[Ar]…. 4s2. Теперь начинается заполнение 3d орбиталей, их пять, следовательно таких d-элементов окажется десять. Sc:…. 3d14s2, Zn: ... 3d104s2. Следует только учесть два обстоятельства 1.- электронные конфигурации атомов хрома и меди. Cr: вместо …3d44s2 - ….3d54s1, Cu: вместо ….3d94s2 - ….3d104s1. Это связано с особой устойчивостью полузаполненных и полностью заполненных электронных оболочек.
2. - Хотя заполняется сначала 4s, а потом 3d орбиталь, при ионизации первыми уходят именно s-электроны. Co: …3d74s2 → Co2+: 3d74s0.
Закончив заполнять 3d-орбиталь, переходим к 4p (n + ℓ = 5) и добираемся до Kr:….3d104s24p6. Дальше ситуация повторяется с d-электронами и f-электронами - 4d (n + ℓ = 6), 4f (n + ℓ = 7), в то время как 5s (n + ℓ = 5). Сначала заполняется 5s (Rb, Sr), затем 4d (Y - Cd), и наконец 5p (n + ℓ = 7, как и у 4d). Закончили на Xe: …4d105s25p6. Теперь приходится заполнять 6s орбиталь, у нее n + ℓ = 6, меньше, чем у 5d и 4f. После лантана La: ….5d16s2 начинается заполнение 4f орбиталей и мы получаем 14 лантанидов.
Все остальные электронные конфигурации студенты могут написать сами.
Слайд 43
Периодичность изменения свойств легко продемонстрировать, двигаясь вдоль периода:
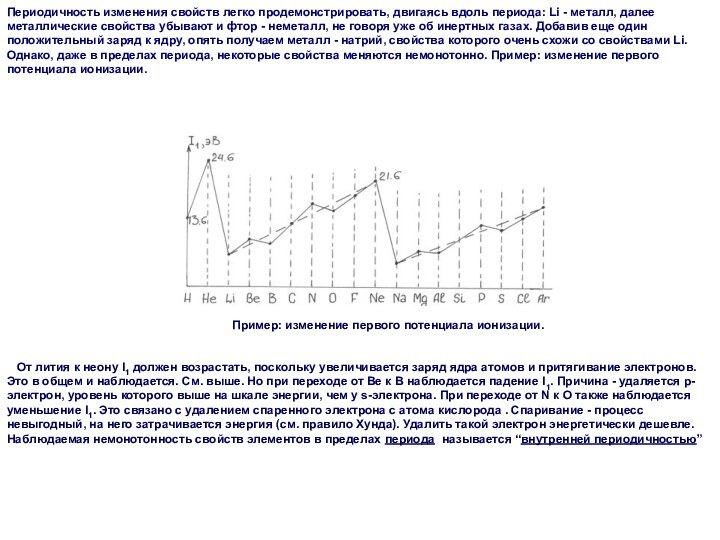
Li - металл, далее металлические свойства убывают и фтор
- неметалл, не говоря уже об инертных газах. Добавив еще один положительный заряд к ядру, опять получаем металл - натрий, свойства которого очень схожи со свойствами Li. Однако, даже в пределах периода, некоторые свойства меняются немонотонно. Пример: изменение первого потенциала ионизации.
Пример: изменение первого потенциала ионизации.
От лития к неону I1 должен возрастать, поскольку увеличивается заряд ядра атомов и притягивание электронов. Это в общем и наблюдается. См. выше. Но при переходе от Be к B наблюдается падение I1. Причина - удаляется p-электрон, уровень которого выше на шкале энергии, чем у s-электрона. При переходе от N к O также наблюдается уменьшение I1. Это связано с удалением спаренного электрона с атома кислорода . Спаривание - процесс невыгодный, на него затрачивается энергия (см. правило Хунда). Удалить такой электрон энергетически дешевле.
Наблюдаемая немонотонность свойств элементов в пределах периода называется “внутренней периодичностью”
Слайд 44
Переходя к следующему периоду, ожидаем уменьшения I1 у
натрия по сравнению с литием, поскольку, хотя заряд ядра
и растет, но внешние электроны экранированы от ядра слоем электронов остова. Это общая закономерность - в группе первый потенциал ионизации уменьшается с ростом порядкового номера элемента. Однако можно обнаружить свойства, которые немонотонно меняются и в пределах группы. Это называется “вторичной периодичностью”. Вторичная периодичность связана с проникновением электронной плотности к ядру. (Ранее мы установили, что , например, s- электроны имеют n максимумов электронной плотности, и первый около ядра). Кстати, вторичная периодичность обычно и связана именно с s -электронами.
Слайд 45
ХИМИЧЕСКАЯ СВЯЗЬ
Основные типы химических связей
Основными типами химических связей,
отличающихся друг от друга электронным строением и механизмом взаимодействия
связываемых атомов, являются ковалентная и ионная связи.
Тип связи в значительной степени определяется разностью электроотрицательностей (Dc) элементов, участвующих в ее образовании:
Dc = c А - c В, где c А и c В - Электроотрицательность атомов А и В.
Электроотрицательность - это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций.
Слайд 46
Молекулой называется любое устойчивое образование из двух или

более атомов. Простейшая нейтральная молекула - молекула водорода Н2.
Это молекула гомонуклеарная. Такие же молекулы образуют азот, галогены, кислород. Совокупность сил, удерживающих два атома водорода в молекуле Н2, описывают словом связь . Эта связь сильна, поскольку при обычной температуре водород существует исключительно в виде молекул. Энергия связи составляет 432 кДж/моль. Как происходит образование связи? См.рис.
Когда атомы находятся далеко друг от друга, энергия их взаимодействия равна нулю. Если атомы сближаются возникают силы притяжения электронов к ядрам соседних атомов, электронные облака перекрываются, образуется связь, энергия системы понижается.
Любая химическая связь образуется с выделением энергии, для ее разрыва требуется затратить энергию, равную энергии связи.
Как описать химическую связь? Это означает, что мы хотим получить правильное значение энергии связи и межатомные расстояния. Давно известны были соединения с полярной связью - соли, например. В них можно предположить, что более электроотрицательный атом отнимает электрон у менее электроотрицательного, после чего атомы притягиваются друг к другу за счет Кулоновского взаимодействия Na+ и Сl-. oднако, для самого электроположительного атома Cs I1=3.89 эВ, это надо затратить. А присоединение электрона к атому Cl c самым большим сродством к электрону дает выигрыш Еа = 3.61 эВ, т.е. затраты не окупаются. На самом деле ионная или близкая к таковой связь может существовать только в кристаллах, где каждый ион окружен несколькими противоионами, что резко увеличивает энергию всей решетки. Т.е. ионная связь характеризуется ненаправленностью, ненасыщенностью. Чем больше ионов противоположного знака вокруг данного иона, тем лучше. Все определяется т.н. стерическими факторами - размерами ионов, их отталкиванием. А что делать с молекулами, как гомоатомными (N2), так и гетероатомными (HCl)? Льюис предложил следующее толкование. Каждая связь образуется в результате перекрывания электронов с образованием электронной пары, при этом каждый атом стремится получить оболочку ближайшего инертного газа и может считать обобществленные электроны своими. Например в молекуле водорода H : H. В молекуле HCl электронная пара оказывается сдвинутой к более электроотрицательному атому H :Cl.
Теория Льюиса близка к изображению связи в виде черточек, соединяющих атомы в графической формуле соединения H- Cl, H-O- Cl.
Но мы опять не имеем ни энергии, ни длины связи. Не поможет ли здесь квантовая химия?
Прежде всего, если уж уравнение Шредингера нельзя было решить для многоэлектронной одноцентровой задачи - атома, то конечно его нельзя решить для задачи, в которой два ядра и два электрона.
Одно из принятых приближений, позволяющих описать химическую связь - это теория валентных связей.
Слайд 47
Химическая связь - это взаимодействие двух

атомов, осуществляемое путем обмена электронами. При образовании химической связи
атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
Ковалентная связь
В органических соединениях этот тип связи является основным. Ковалентная связь возникает между атомами с относительно малыми различиями в электроотрицательностях (δχ < 2), например: H- H, С- C, С-H,C-О, которые образуют химическую связь за счет общей электронной пары.
Связь, образованная путем обобществления пары электронов связываемых атомов, называется ковалентной
Эта связь может рассматриваться как электростатическое притяжение ядер двух атомов к общей электронной паре. Ковалентная связь, в отличие от ионной, обладает определенной направленностью (от атома к атому), и ее обозначают валентной чертой, символизирующей эту направленность: H-H, С-C, С-H, C-O.
Ионная связь точнее отражается знаками зарядов ионов: Na+CI-
Для ковалентных соединений характерно молекулярное строение (молекулярные кристаллические решетки), они имеют относительно низкие температуры плавления и кипения. Такие соединения малополярные, плохо растворимы в воде, их растворы не проводят электрический ток.
Осуществляется ковалентная связь за счет электронной пары,
принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
Слайд 48
Ковалентная связь, образующаяся за счет пары
электронов одного из атомов, т.е. по донорно-акцепторному механизму, называется
дoнорно-акцeпторной. Например, такая связь образуется между атомом азота в молекуле метиламина CH3 NH2 и протоном Н+ кислоты НСl:
Атом азота отдает свою электронную пару на образование связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд.
Донорно-акцепторная связь отличается только способом образования; по свойствам она одинакова остальными ковалентными связями.
Другой пример
- протонирование спирта:
Два атома могут обобществлять несколько пар электронов.
В этом случае говорят о кратных связях:
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность лектроотрицательностей атомов.
Слайд 50
Кратные связи
Встречающиеся в органических соединениях кратные связи (двойные
или тройные):
H2C ═ CH2; R2C ═ O;
HC ≡ CH; RC ≡ N
образуются при обобществлении двумя атомами более чем одной пары электронов:
Н2С : : СН2; R2С : : О; HС : : : CH; RС : : : N и т.д.
Кратные связи являются сочетанием σ - и π - связей.
Двойная связь состоит из одной σ - и одной π -связей и осуществляется 4-мя общими электронами.
Тройная связь является комбинацией из одной σ- и двух π-связей и включает в себя шесть электронов.
Число электронных пар, участвующих в образовании ковалентной связи называется порядком связи.
Таким образом, порядок простой связи равен 1, двойной - 2, тройной - 3.
В случае сопряженных (делокализованных) связей порядок связи отличается от этих целочисленных значений.

Свойства ковалентной связи
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Характеристики ковалентной связи
Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
Энергия связи - энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
Длина связи - расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Дипольный момент связи ( µ ) - векторная величина, характеризующая полярность связи. Длина вектора равна произведению длины связи ℓ на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = ℓ • q. Вектор дипольного момента направлен от положительного заряда к отрицательному заряду. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.
На характеристики связей влияет их кратность:
энергия связи увеличивается в ряду: C- С < C= C < C ≡ C
длина связи растет в обратном порядке: C ≡ C< C= C < C- С
σ- и π - Связи
σ - Связь - ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов.
- Связь - ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
π -cвязи образуются между атомами, уже соединенными σ -связью.
Эта cвязь слабее σ-связи из-за менее полного перекрывания р-АО.
Слайд 53
Различное строение σ- и π-молекулярных орбиталей определяет характерные

особенности σ - и π- связей.
σ -
Связь прочнее π - связи. Это обусловлено более эффективным перекрыванием АО при образовании σ - МО и нахождением σ - электронов между ядрами.
По σ - связям возможно внутримолекулярное вращение атомов, т.к. форма σ - МО допускает такое вращение без разрыва связи.
Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π -связи значительно выше, чем σ-связи.
Делокализованные π-связи.
Ковалентная связь считается локализованной, если ее электронная пара находится в поле двух ядер и связывает только два атома.
Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобие металлической связи).
Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей, т.е. кратных связей, чередующихся с одинарными.
Рассредоточение электронов - энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации π-электронов является π-перекрывание р-АО соседних sp2- или sp-атомов, лежащих в одной плоскости. С помощью атомно-орбитальной модели можно показать, как происходит делокализация π -связей в молекуле бутадиена:
Делокализация π-электронов приводит к тому, что в сопряженной системе связи становятся нецелочисленными (дробными), т.е. ни двойными или тройными, ни одинарными. Иначе говоря, связи имеют нецелочисленный порядок.
Слайд 54
Примеры соединений с делокализованными связями: бензол, другие органические
соединения:
Система сопряжения может быть открытой или замкнутой и содержать
атом (С, N, O, S, Cl и т.д.) с неподеленной электронной парой (I, II), с неспаренными электрономи (III) или с вакантной р-АО (IV):
Неполярная ковалентная связь
Неполярная (симметричная) ковалентная связь - связь между атомами с практически равной электроотрицательностью (0,4 > δχ = 0) и, следовательно, равномерным распределением электронной плотности между ядрами атомов.
Слайд 55
Например: Н - Н, F - F,
C I - CI, C – C.
а) Дипольный момент таких связей C I - CI равен 0 молекула СI2 неполярная.
б) Дипольный момент связи Н - CI равен 1,04 D молекула НСI полярная.
Связь C - Н в предельных углеводородах (например, в СН4) считается практически неполярной, т.к. δχ = 2.5 (с) - 2.1(Н) = 0,4.
Следует отметить, что в непредельных углеводородах
(СН2═СН2, Н – С ≡ С – Н , R– С ≡ С – Н и т.п.)
Электроотрицательность углерода выше и связь C- Н полярная, особенно если атом водорода связан с углеродом, имеющим тройную связь:
(Н – С ≡ С – Н , R– С ≡ С – Н)
Слайд 56
Полярная ковалентная связь
Полярная (несимметричная) ковалентная связь - связь

между атомами с различной электроотрицательностью (2 > Dc >
0.5) и несимметричным распределением общей электронной пары. Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда d- (дельта минус), а на менее электроотрицательном атоме - частичного положительного заряда d+ (дельта плюс):
C d+ – CI d-, C d+ – O d-, C d+ – N d-, O d- – H d+, C d- - Mg d+, H d+ - CId-
Направление смещения электронов обозначается также стрелкой:
C ® Cl, C ® О, C ® N, О ← Н, C← Mg, H ← CI
Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи и больше ее дипольный момент. Между противоположными по знаку частичными зарядами действуют дополнительные силы притяжения, увеличивая прочность связи.
Природа ковалентная связь
Как же происходит обобществление электронов при образовании ковалентной связи?
Электронная пара становится общей для связываемых атомов и притягивает их ядра при взаимном объемном перекрывании атомных орбиталей этих атомов. Поэтому более полным определением понятия ковалентной связи является следующее:
Связь, образованная путем обобществления пары электронов в результате перекрывания атомных орбиталей связываемых атомов, называется ковалентной.
Слайд 57
Ионная связь
Химическая связь, основанная на электростатическом притяжении ионов,

называется ионной связью.
Такая связь возникает при большой разнице в
электроотрицательностях связываемых атомов (δχ > 2), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом. Например, в хлориде натрия NaCl разность
электроотрицательностей атомов равна:
δχ = 3.0(Cl) - 0.9(Na) = 2.1.
Атом Na (1 электрон на внешнем уровне) и атом Cl (7 внешних электронов) превращаются в ионы Na+ и Cl- с завершенными внешними электронными оболочками (по 8 электронов), между которыми возникает электростатическое притяжение, т.е. ионная связь. Иoннaя связь не имеет пространственной направленности, так как каждый ион связан с некоторым числом противоионов, сила действия которых зависит от расстояния (закон Кулона). Поэтому ионно-связанные соединения не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения, они высокополярны, часто солеобразны, в водных растворах электропроводны. Соединений с чисто ионными связями практически не существует.
В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять , ни приобретать электроны с образованием ионов.
Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
(фторид натрия состоит из ионов натрия Na+ и фторид-ионов F-)
Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы. Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью.
Как взаимодействуют атомные орбитали при образовании молекул?
1. При взаимодействии (перекрывании) атомных орбиталей, принадлежащих ДВУМ (или более) атомам, образуются молекулярные орбитали (МО). Причем их число равно числу исходных АО: n АО ® n МО.
2. Молекулярные орбитали заселяются обобществленными электронами и таким образом осуществляют ковалентную связь.
3. Образованию молекулярных орбиталей может предшествовать взаимодействие атомных орбиталей ОДНОГО атома, приводящее к гибридизации (смешению) этих орбиталей и возникновению гибридных АО. Гибридные орбитали в свою очередь могут участвовать в образовании молекулярных орбиталей, перекрываясь с атомными орбиталями других атомов.
Гибридизация атомных орбиталей возможна лишь для атомов, образующих химические связи, но не для свободных атомов!
Слайд 58
Гибридизация атомных орбиталей
См. файл образование молекул, внести дополнения.
Гибридизация
орбиталей - это изменение формы некоторых орбиталей при образовании
ковалентной связи для достижения более эффективного перекрывания орбиталей
sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'.
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию(CH4,NH3).
Орбитальная модель атома в sp3-гибридизованном состоянии.
Для атома углерода и других элементов 2-го периода этот процесс происходит по схеме: 2s + 2px + 2py + 2pz =4 (2sp3)
Слайд 59
Схема sp3-гибридизации атомных орбиталей.
Оси
sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол
между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов.
Впервые идею о направленности единиц сродства (валентностей) атома углерода по углам тетраэдра независимо друг от друга выдвинули в 1874 г. Вант-Гофф и Ле Бель.
sp3-Орбитали могут образовывать четыре -связи с другими атомами или заполняться неподеленными парами электронов.
Слайд 60
А как наглядно изобразить пространственное строение атома в
sp3-состоянии на рисунке?
В этом случае sp3-гибридные орбитали изображают
не электронными облаками, а прямыми линиями или клиньями в зависимости от пространственной ориентации орбитали. Такое схематическое изображение используется при написании стереохимических (пространственных) формул молекул.
Переход от орбитальной модели (а) к пространственной формуле (б).
На примере молекулы метана показаны объемные модели и пространственная (стереохимическая) формула молекулы с sp3-углеродным атомом.
Слайд 61
Модель молекулы метана
sp3 -Гибридизованное состояние свойственно атому, если
сумма числа связанных с ним атомов и числа его
неподеленных электронных пар равна 4.
sp3-Гибридизация атомов в различных соединениях.
Слайд 62
Cтроение молекулы этана C2H6 иллюстрируют модель
Модель молекулы этана
С2Н6
о σ-связи С-С происходит внутримолекулярное вращение. Углерод в sp3-гибридном
состоянии встречается в простом веществе - алмазе
Слайд 63
Это состояние характерно для атомов С, N, O

и др., соединенных с другими атомами одинарными связями (sp3-атомы
выделены красным цветом): СH4, RCH3, NH3, RNH2, H2O, ROH, R2O; а также анионам типа: R3C-:, RO- и т.п. Следствием тетраэдрического строения sp3-атома является возможность существования двух оптических стереоизомеров-атома является возможность существования двух оптических стереоизомеров у соединения, содержащего такой атом с четырьмя разными заместителями (Вант-Гофф-атома является возможность существования двух оптических стереоизомеров у соединения, содержащего такой атом с четырьмя разными заместителями (Вант-Гофф, Ле Бель, 1874).
sp2- Гибридизация (плоскостно-тригональная)
sp2 - гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°. Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию.
Для элеметов 2-го периода процесс sp2-гибридизации происходит по схеме:
2s + 2px + 2py = 3 (2sp2 ) 2pz - АО в гибридизации не участвует.
Слайд 64
Рисунок sp2 - гибридизированном состоянии
Слайд 65
Для изображения пространственного строения атомов в sp2-состоянии используются
те же приемы, что и в случае sp3-атомов:
Переход от
орбитальной модели атома в sp2-гибридизированном состоянии (а) к пространственной формуле (б).
Строение молекул с sp2-атомами отражают их модели:
sp2-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 3
Слайд 66
Пример
Углерод в sp2-гибридном
состоянии образует простое вещество графит. Это состояние характерно для
атомов С, N, О и др. с двойной связью (sp2-атомы выделены красным цветом): Н2С=СН2 (анимация), H2C=CHR, R2C=NR,
R ─ N= N – R, R2C=O , R─N=O , а также для катионов типа R3C+ и свободных радикалов R3C─.
Слайд 67
sp-Гибридизация (линейная)
Рассмотрим строение молекулы BeCI2.
Электронная формула 4Be –
1s22s22p0 – валентный электронный слой
Бериллий - центральный атом
2s 2p
Be – в этом соединении двухвалентен, а валентность определяет число неспаренных электронов. В реакцию с хлором он вступает в возбужденном состоянии, при котором электроны распариваются. Электрон с 2s орбитали переходит на 2рх орбиталь, ру и рz орбитали участие в образовании химической связи не принимают.
2s 2p
Be*
Одна s- и одна Р-орбитали смешиваются, образуя две равноценные sp-орбитали гибридные орбитали, расположенные под углом 1800 , т.е. на одной оси.
Гибридные sp-орбитали участвуют в образовании двух σ -связей. Две Р-орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях:
Р-орбитали образуют в соединениях две π - связи. Для элементов 2-го периода sp-гибридизация происходит по схеме:
2s + 2px= 2 (2sp)
2py- и 2pz - АО не изменяются.
Be
Слайд 68
Схема sp-гибридизации
Для простоты изображения пространственного
строения sp-атома обычно рисуют Р-орбитали в форме электронных облаков,
а гибридные орбитали изображают прямыми линиями:
Слайд 69
Строение молекул с sp-атомами отражают их модели:
Слайд 70
sp-Гибридизованное состояние свойственно атому, если сумма числа связанных
с ним атомов и числа его неподеленных электронных пар
авна 2.
Углерод в sp-гибридном состоянии присутствует:
в соединениях с тройной связью …HC≡CH , RC≡CR, RC≡N;
в соединениях типа R2C═C═CR2
в простом веществе - карбине , cтроение которого представляют формулами:
…─C≡C─C≡C─C≡…. или ....═С═С═С═С═С═ ….
Слайд 71
Пример1. Что такое гибридизация валентных орбиталей?
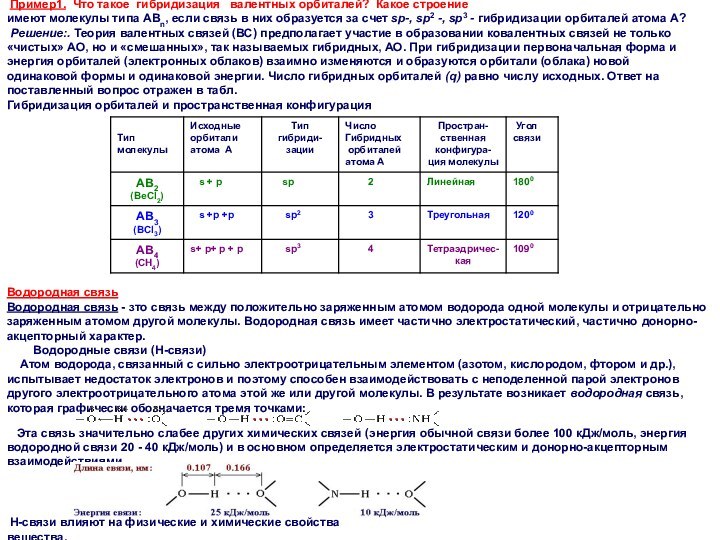
Какое строение
имеют молекулы типа АВn, если связь в них
образуется за счет sp-, sp2 -, sp3 - гибридизации орбиталей атома А?
Решение:. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только «чистых» АО, но и «смешанных», так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей (q) равно числу исходных. Ответ на поставленный вопрос отражен в табл.
Гибридизация орбиталей и пространственная конфигурация
Водородная связь
Водородная связь - зто связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
Водородные связи (Н-связи)
Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, которая графически обозначается тремя точками:
Эта связь значительно слабее других химических связей (энергия обычной связи более 100 кДж/моль, энергия водородной связи 20 - 40 кДж/моль) и в основном определяется электростатическим и донорно-акцепторным взаимодействиями.
Н-связи влияют на физические и химические свойства вещества.
Слайд 72
Почему связи типа водородных не образуют атомы других

элементов?
Это объясняется тем, силы электростатического
притяжения разноименных концов диполей полярных связей (О-Н, N-H и т.п.) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей.
Водородная связь изображена точками
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот.
Металлическая связь
Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла.
Ее суть состоит в том, что каждая связь рассматривается как состоящая из двух электронов и для каждого имеется атомная электронная функция ϕ.
Виды кристаллических решеток
Кристаллические решетки металлического типа содержат в узлах положительно заряженные ионы и нейтральные атомы; между ними передвигаются относительно свободные электроны.
Металлическая связь. Делокализация электронов в металлах с образованием зон проводимости. Электроны подвижны, но ни в коем случае не бегут по проводнику (от Красноярска до Ст.Петербурга) а просто передают энергию друг другу, как цепочка шаров, которые толкнули с одного конца.
Слайд 73
Метод молекулярных орбиталей
Считаем, что все
электроны движутся в поле всех ядер, составляющих молекулу по
неким молекулярным орбиталям.
Сначала строим орбитали, забыв про существование электронов, потом рассаживаем по ним электроны.
Как строим орбитали? Приближение ЛКАО - линейная комбинация атомных орбиталей (проще говоря их алгебраическая сумма с разными коэффициентами).
В молекуле Н2 два электрона, по принципу Паули они оба сядут на σсв.
Тогда мы будем иметь электронную пару как и в методе ВС.
Кратность связи n определяется в методе МО как Ѕ(σсв- σразр). т.е:
H2+ σсв1 n = 1/2
H2 σсв2 n = 1
но! He2+ σсв2 σ*1 n = 1/2 - может существовать,
в то время как He2 σсв2 σ*2 n = 0 - не может существовать.
Слайд 74
Двухатомные молекулы элементов 2 периода
Для двухатомных молекул Li2

- Ne2 атомным базисом, т.е. теми орбиталями, которые могут
принимать участие в связи будут валентные 2s и 3 2p орбитали от каждого атома. (Мы пока забыли кто сколько имеет электронов). Можно, конечно, подставить их все восемь в уравнение (1), но получится очень сложная матрица. Сделаем проще - воспользуемся некоторыми правилами создания молекулярных орбиталей.
1. Из n атомных орбиталей должны получить n молекулярных орбиталей.
2. Связывающие и разрыхляющие орбитали получаются в результате перекрывания атомных орбиталей .
3. Перекрывание определяется геометрией атомных орбиталей (грубо говоря, те орбитали, которые торчат в разные стороны, не перекрываются)
4. Перекрываются орбитали, близкие по энергии.
5. При рассаживании электронов будем руководствоваться принципами
минимума энергии, Паули и правилом Хунда.
Из рисунка видно, что перекрываются прежде всего s - s и px - px. Но поскольку s и p имеют разную энергию, то в первом приближении можно считать, что они и перекрываются только друг с другом. Тогда:
1) ψ1= s1+s2 σ1св
2) ψ2= s1 - s2 σ1*
3) ψ3= px1 - px2 σ2св (см. знаки ф-ий)
4) ψ4= px1+px2 σ2*
Слайд 75
Теперь разберемся с py и pz. Очевидно, что
они
перекрываются только друг с другом и при этом по
π типу. Это перекрывание меньше и орбитали меньше разъедутся по энергии. Также очевидно,, что мы получим одинаковые по энергии орбитали.
Получили 8 орбиталей как и требовалось. Но мы сделали одно предположение, которое может оказаться слишком нестрогим: рассматривали отдельно перекрывание s и px орбиталей. В конце периода, действительно эти атомные орбитали сильно разнятся по энергии и это предположение оправдано. Но в начале они близки по энергии и их надо рассматривать все вместе, что приводит к некоторому нарушению порядка МО - σ2 связывающая и разрыхляющая орбитали под “давлением” σ1 как бы поднимаются вверх и σ2св оказывается выше πcв . См. рис. Вот теперь можно рассмотреть конкретно каждую молекулу.
Слайд 76
Молекула Ne2 существовать не может. Но молекула NeF
уже имеет право на существование, поскольку главное правило возможности
существования молекул - количество электронов на связывающих орбиталях должно быть больше, чем на разрыхляющих.
Вывод: МО объяснила нам существование электронодефицитных молекул (H2+), парамагнетизм молекулы кислорода, возможность инертных газов вступать в химические связи. Она объясняет особую прочность молекулы СО: в этой молекуле как и в молекуле азота 10 электронов (4 от С и 6 от О, но в методе МО не важно чьи были электроны), следовательно, связь в ней тройная.
Недостатки МО
1) Она не наглядна.
2) Не дает геометрии молекул.
Слайд 77
Комплексные, или координационные, соединения относятся к многочисленному классу

соединений, в состав которых могут входить как неорганические, так
и органические соединения в виде нейтральных или заряженных частиц. По своей многочисленности они занимают второе место после органических соединений.
CuSO4+2NaOH=
Cu(OH)2+Na2SO4
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Cu(OH)2
Такие соединения называются соединениями высшего порядка, или комплексными.
Современная координационная химия связана с именем швейцарского химика А. Вернера, сформулировавшего основные положения координационной теории (1893 г.).
По этой теории центром комплексного соединения является ион метала, как правило, d - элемента, реже p – элемент.
Центральный ион (атом) комплексного соединения называется комплексообразователем.
Координационными называют соединения, содержащие в одном из агрегатных состояний группу ионов или нейтральных молекул (лигандов), в определенном порядке размещенных (координированных) вокруг атома (иона) - комплексообразователя)
[Cu(NH3)4](OH)2
Лигандами могу быть нейтральные молекулы (NH3, H2O, CO), кроме того, лигандами являются различные анионы, различные кислотные остатки (OH-, Cℓ-, Br-. J-, NO2-, SO42-, CN-, CNS- и т.д. ).
Cu(OH)2
Слайд 78
Число, стоящее за круглыми скобками
внутренней сферы, называется координационным числом.
Координационное число показывает, какое
количество лигандов координирует вокруг себя данный комплексообразователь. Таким образом
комплексообразователь имеет две характеристики:
заряд координационное число.
Комплексообразователь с лигандами образуют (внутреннюю сферу комплексного соединения), или комплексный ион.
[Cu(NH3)]2+; [BiJ4]- .
Координационное число (число лигандов), как правило, равно удвоенному заряду центрального атома – комплексообразователя.
Заряд комплексного иона представляет собой алгебраическую сумму зарядов комплексообразователя и лигандов.
Слайд 79
Система названий комплексных соединений
Название комплексного соединения зависит от

того, катионом или анионом является внутренняя сфера.
Число лигандов каждого
вида обозначается греческими числительными:
1-моно,
2-ди,
3-три,
4-тетра,
5-пента,
6- гекса.
Названия наиболее распространенных лигандов:
NH3-аммин,
Н2О-аква,
Сl- - хлоро,
NO2--нитрито,
CN- -циано,
S2O32--тиосульфато.
Если комплексный ион является катионом, то название соединения формируется следующим образом:
1. Анион внешней сферы.
2. Катион внутренней сферы:
координационное число,
лиганды,
комплексообразователь (русское название элемента в родительном падеже),
заряд комплексообразователя.
Отсюда:
[Ag(NH3)2]Cl - хлорид диаммин cеребра (1),
[Cu(NH3)4](OH)2 - гидроксид тетрааммин меди (2).
Если комплексный ион является анионом, то название соединения формируется следующим образом:
1. Комплексный анион:
• координационное число,
• лиганды,
• комплексообразователь (латинское название элемента, в котором окончание "ум" заменено на окончание "ат"),
•заряд комплексообразователя.
2. Катион внешней сферы.
Например:
К3[BiI4] - тетраиодовисмутат (III) калия.
Слайд 80
Диссоциация комплексных соединений и ионов
Между ионом внешней и
внутренней сфер возникает ионная связь, поэтому комплексные соединения диссоциируют
на ионы необратимо:
K3[Fe(CN)6]=3K++[Fe(CN)6]3-.
Между комплексообразователем и лигандами возникает донорно-акцепторная связь (комплексообразователь - акцептор, лиганды - доноры), поэтому комплексный ион диссоциирует как слабый электролит:
[Fe(CN)6]3- ⮀ Fe3+ +6CN-
Диссоциация комплексных ионов имеет количественную характеристику - константу нестойкости (Кн):
В зависимости от константы нестойкости комплексные ионы подразделяются на нестойкие, устойчивые, очень устойчивые.
Чтобы разрушить комплексный ион, необходимо сместить его равновесие в сторону прямой реакции.
Так как при разбавлении растворов диссоциация усиливается, для разрушения неустойчивых комплексных ионов достаточно разбавить раствор водой.
Устойчивые комплексные ионы разрушают химическим воздействием, либо на комплексообразователь, либо на лиганды.
Это означает, что или комплексообразователь, или лиганды надо удалить из раствора в виде более труднорастворимого соединения, чем разрушаемый комплексный ион.
Слайд 81
Например, надо разрушить устойчивый ион
[Ag(NH3)2]+, имеющий Кн =
![Химия Например, надо разрушить устойчивый ион[Ag(NH3)2]+, имеющий Кн = 10-8. Если на](/img/tmb/11/1077522/728da84c8e6d3360eb9240187db1a9cb-720x.jpg)
10-8.
Если на раствор, содержащий данный ион, воздействовать
раствором иодида калия, то ионы серебра будут удалены из раствора в виде AgI, имеющего произведение растворимости, равное 10-17.
Если воздействовать азотной кислотой, то лиганды, молекулы NH3, будут связаны в комплексный ион [H(NH3)]+, константа нестойкости которого равна 10-14. В обоих случаях понизится концентрация продуктов реакции:
[Ag(NH3)2]+⮀ Ag+ +2NH3
и по принципу Ле Шателье равновесие реакции сместится в прямом направлении, в сторону разрушения комплексного иона. Процессы комплексообразователя широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант нестойкости образуемых ими комплексных соединений.
Классификация комплексных соединений
Комплексные соединения подразделяются на электролиты и неэлектолиты.
Комплексные неэлектролиты:
Последнее соединение называется неоднородным комплексным соединением, так как комплексообразователь координирует вокруг себя различные лиганды.
Комплексные электролиты подразделяются на кислоты, гидроксиды и соли.
H[AuCl3] - трихлорозолотая кислота.
H2[PtCl6] - гексахлороплатиновая кислота.
[Cu(NH3)4](OH)2- гидроксид тетрааммин меди (II).
[Ni(NH3)6]SO4- сульфат гексааммин никеля (II).
Комплексные соединения классифицируются по виду лигандов.
Если лигандами служат молекулы аммиака, комплексные соединения называются аминокомплексами.
Если лигандами служат молекулы H2O, то комплексные соединения называются аквакомплексами.
Если лиганды – ОН-, то комплексные соединения называются гидрокомплексами.
Если лигандами служат любые кислотные остатки, то комплексные соединения называются ацидокомплексами.
Слайд 82
Применение комплексных соединений
1. Из комплексных соединений
добывают металлы, используемые для нанесения покрытий.
2. Многие
металлы, особенно тяжелые, образуют с органическими соединениями комплексоны, т.е. происходит связывание токсичных металлов в комплексоны, что приводит к понижению их концентрации. Это используется для отчистки загрязненной воды и для производства лекарств, которые выводят тяжелые металлы из организма.
3. Первые вещества, отнесенные к комплексным, использовались берлинским цехом художников как краски - турнбулиева синь и берлинская лазурь. Сегодня эти вещества используют в аналитической химии как реагенты на ионы Fe2+ и Fe3+.
4. Гемоглобин и хлорофилл, без которых невозможно представить жизнь на Земле, - это тоже комплексные соединения.
5. На процессах комплексообразования основано отделение золота от пустой породы.
6. Фотографический процесс также немыслим без комплексных соединений (рисунок).
Слайд 83
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Степень окисления
Степень окисления - это

условный заряд атома в молекуле, вычисленный в предположении, что
молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью.
Например:
N2H4 (гидразин)
степень окисления азота – -2; валентность азота – 3.
Расчет степени окисления
Для вычисления степени окисления элемента следует учитывать следующие положения:
1. Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
Слайд 84
Реакции без и с изменением степени окисления
Существует два

типа химических реакций:
A. Реакции, в которых не изменяется степень
окисления элементов:
Реакции присоединения SO2 + Na2O => Na2SO3
Реакции разложения Cu(OH)2 –t° => CuO + H2O
Реакции обмена AgNO3 + KCl => AgCl¯ + KNO3
NaOH + HNO3 => NaNO3 + H2O
B. Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений:
2Mg0 + O20 => 2Mg+2O-2
2KCl+5O3-2 –t°=> 2KCl-1 + 3O20
2KI-1 + Cl20 => 2KCl-1 + I20
Mn+4O2 + 4HCl-1 => Mn+2Cl2 + Cl20 + 2H2O
Такие реакции называются окислительно - восстановительными.
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим.
Процесс отдачи электронов – окисление..
При окислении степень окисления повышается:
H20 - 2ē => 2H+
S-2 - 2ē => S0
Al0 - 3ē => Al+3
Fe+2 - ē => Fe+3
2Br - - 2ē => Br20
Процесс присоединения электронов – восстановление.
При восстановлении степень окисления понижается.
Mn+4 + 2ē => Mn+2
S0 + 2ē => S-2
Cr+6 +3ē => Cr+3
Cl20 +2ē => 2Cl-
O20 + 4ē => 2O-2
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, которые отдают электроны - восстановителями.
Слайд 85
Окислительно-восстановительные свойства вещества и степени окисления входящих в

него атомов
Соединения, содержащие атомы элементов с максимальной
степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
Важнейшие восстановители и окислители
Слайд 86
Классификация окислительно-восстановительных реакций
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся

в разных веществах; обмен электронами в этих реакциях происходит
между различными атомами или молекулами:
S0 + O20 => S+4O2-2
S - восстановитель; O2 - окислитель
Cu+2O + C+2O => Cu0 + C+4O2
CO - восстановитель; CuO - окислитель
Zn0 + 2HCl => Zn+2Cl2 + H20
Zn - восстановитель; HСl - окислитель
Mn+4O2 + 2KI-1 + 2H2SO4 => I20 + K2SO4 + Mn+2SO4 + 2H2O
KI - восстановитель; MnO2 - окислитель.
Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления
-2 +4
2H2S + H2SO3 => 3S0 + 3H2O
H2S – восстановитель; H2SO3 – окислитель.
Внутримолекулярные окислительно- восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
+5 -2 -1 0
2KClO3=> 2KCl + 3O2
Cl+5 - окислитель; О-2 - восстановитель
-3 +5 +1
NH4NO3 –t° => N2O + 2H2O
N+5 - окислитель; N-3 - восстановитель
+5 -2 +4
2Pb(NO3)2 => 2PbO + 4NO2 + O20
N+5 - окислитель; O-2 – восстановитель
Опыт. Разложение дихромата аммония:
-3 +6 +3
(NH4)2Cr2O7 –t°=> Cr2O3 + N20 + 4H2O
Cr+6 - окислитель; N-3 - восстановитель.
Слайд 87
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент

одновременно повышает и понижает степень окисления.
+1 -1
Cl20 + 2KOH => KClO + KCl + H2O
+6 +7 +4
3K2MnO4 + 2H2O => 2KMnO4 + MnO2 + 4KOH
+3 +5 +2
3HNO2 => HNO3 + 2NO + H2O
+4 +5 +3
2NO2 + 2KOH => KNO3 + KNO2 + H2O
Составление уравнений окислительно-восстановительных реакций
A. Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl → KCl + MnCl2 + Cl2↑ + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 → KCl + Mn+2Cl2 + Cl20↑ + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē → Mn+2
2Cl-1 - 2ē → Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
––––––––––––––––––––––––
2Mn+7 + 10Cl-1 → 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
+7 1- +2
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl20 + 8H2O
Слайд 88
B. Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов,
в котором рассматривается обмен электронами между ионами в растворе
с учетом характера среды:
––––––––––––––––––––––––––––––––––––––
10Cl- + 2MnO41- + 16H+ → 5Cl20↑ + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+ , OH- или воду)
Типичные реакции окисления-восстановления
Реакции с участием перманганата калия в качестве окислителя
При взаимодействии перманганата калия с восстановителем образуются различные продукты восстановления в зависимости от pH среды.
Реакции в кислой среде.
+4 +7 +6 2+
5K2SO3 + 2KMnO4 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O
электронный баланс
метод полуреакций
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 16H+ + 5SO32- + 5H2O → 2Mn2+ + 8H2O + 5SO42- + 10H+
или 2MnO4- + 6H+ + 5SO32- → 2Mn2+ + 3H2O + 5SO42-
Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора K2SO3.
Слайд 89
Реакции в нейтральной среде
+4 +7 +6 +4
3K2SO3 + 2KMnO4 + H2O → 3K2SO4 +2MnO2↓ + 2KOH
электронный баланс
метод полуреакций:
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 4H2O + 3SO32- + 6OH- → 2MnO2 + 8OH- + 3SO42- + 3H2O
или 2MnO4- + H2O + 3SO32- → 2MnO2 + 2OH- + 3SO42-
Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
Реакции в щелочной среде.
+4 +7 +6 +6
K2SO3 + 2KMn4 + 2KOH → K2SO4 +2K2MnO4 + H2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––––––
SO32- + 2OH- + 2MnO4- → SO42- + H2O + 2MnO42-
Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4.
Таким образом:
Слайд 91
Реакции с дихроматом калия в качестве окислителя
Степень окисления
хрома понижается с +6 до +3. Наблюдается изменение окраски
реакционной массы с желто-оранжевого цвета до зеленого или фиолетового.
+6 -2 3+
1. K2Cr2O7 + 3H2S + 4H2SO4 → K2SO4 + Cr2 (SO4)3 + 3S0↓ + 7H2O
электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––––
Cr2O72- + 8H+ + 3H2S → 2Cr3+ + 7H2O + 3S0
+6 2+ 3+ 3+
2) K2Cr2O7 + 6FeSO4 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––––––
6Fe2+ + Cr2O72- + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O
Слайд 92
3) K2Cr2+6O7 + 14HCl-1 → 3Cl20↑ + 2KCl +
2Cr+3Cl3 + 7H2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––––
Cr2O72- + 6Cl- + 14H+
→ 2Cr3+ + 3Cl20 + 7H2O
Окислительные свойства азотной кислоты
Окислителем в молекуле (см. также "Азотная кислота") азотной кислоты является N+5, который в зависимости от концентрации HNO3 и силы восстановителя (например, активности металла - см. также тему " Азотная кислота") принимает от 1 до 8 электронов, образуя
+4 +2 +1 0 -3
NO2; NO; N2O; N2; NH3 или NH4NO3;
+5 +2 +4
1) Cu0 + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O
электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––
Cu0 + 2NO3- + 4H+ → Cu2+ + 2NO2 + 2H2O
Слайд 93
2) 3Ag0 + 4HNO3 (конц.) → 3AgNO3 +
NO↑ + 2H2O
электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––
3Ag0 + NO3- + 4H+
→ 3Ag+ + NO + 2H2O
3) 5Co0 + 12HNO3(разб.) → 5Co(NO3)2 + N2↑ + 6H2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––
5Co0 + 2NO3- + 12H+ → 5Co2+ + N2 + 6H2O
4Ca0 + 10HNO3(оч.разб.) → 4Ca (NO3)2 + NH4NO3 +
3H2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––
4Ca0 + NO3- + 10H+ → 4Ca2+ + NH4+ + 3H2O
При взаимодействии HNO3 с неметаллами выделяется, как правило, NO:
+5 +4 +2
1) 3C0 + 4HNO3 → 3CO2↑ + 4NO↑ + 2H2O
электронный баланс:
метод полуреакций:
–––––––––––––––––––––––––––––––––––––––––––––
3C0 + 6H2O + 4NO3- + 16H+ → 3CO2 + 12H+ + 4NO + 8H2O
или 3C0 + 4NO3- + 4H+ → 3CO2 + 4NO + 2H2O
Слайд 95
2) 3P0 + 5HN+5O3 + 2H2O → 3H3P+5O4
+ 5N+2O↑
электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––––––––––––––––––
3P0 + 12H2O + 5NO3- +
20H+ → 3PO43- + 24H+ + 5NO + 10H2O
или 3P0 + 2H2O + 5NO3- → 3PO43- + 4H+ + 5NO
Пероксид водорода в окислительно-восстановительных реакциях
1. Обычно пероксид водорода используют как окислитель:
H2O2 + 2HI-1 → I20 + 2H2O
электронный баланс:
метод полуреакций:
––––––––––––––––––––––
2I- + H2O2 + 2H+ → I2 + 2H2O
Слайд 96
При действии сильных окислителей пероксид водорода может окисляться,
образуя кислород и воду.
5H2O2 + 2KMn+7O4 + 3H2SO4 →
5O20↑ + K2SO4 + 2Mn2+SO4 + 8H2O
электронный баланс:
метод полуреакций:
––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 5H2O2 + 16H+ → 2Mn2+ + 8H2O + 5O2 + 10H+
или 2MnO4- + 5H2O2 + 6H+ → 2Mn2+ + 8H2O + 5O2
Слайд 97
Тепловой эффект реакции
В ходе

реакции происходит разрыв связей в исходных веществах и образование
новых связей в продуктах реакции. Поскольку образование связи идет с выделением, а ее разрыв - с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Энергия выделяется, если рвущиеся связи в исходных веществах менее прочны, чем связи, образующиеся в продуктах реакции, в противном случае - энергия поглощается. Обычно энергия выделяется и поглощается в форме теплоты, т.е. химическая форма энергии преобразуется в тепловую. Таким образом, химические реакции сопровождаются тепловыми эффектами.
Тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
Тепловой эффект обозначается символами Q или ΔH (Q = −ΔH). Его величина соответствует разности между энергиями исходного и конечного состояний реакции:
ΔH = Hкон.− Hисх. = Eкон.− Eисх.
Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект ( Q >0, ΔH<0) и называются экзотермическими.
Реакции, которые идут с поглощением теплоты из окружающей среды
(Q < 0, ΔH > 0), т.е. с отрицательным тепловым эффектом, являются эндотермическими.
Энтальпия (H ) и энергия Гиббса
Энергетика химических процессов.
(термодинамические расчёты)
Слайд 98
Энтальпия - энергосодержание системы, включает внутреннюю энергию и

величину работы системы против внешних сил.
Термохимия-раздел термодинамики, посвящённый изучению
тепловых эффектов реакций. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называют энтальпией реакции (∆H) и выражают в килоджоулях (кДж).
Для экзотермических реакций ∆H<0, для эндотермических - ∆H>0. Энтальпию образования 1 моль данного вещества из простых веществ, измеренную при температуре 298 К (25º C) и давлении 101,825 кПа (1 атм), называют стандартной ∆Hº298 (к Дж/моль). Энтальпии простых веществ условно принимают равными нулю.
В основе термохимических расчётов лежит закон Гесса (1840): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Часто в термохимических расчётах применяют следствие из закона Гесса: тепловой эффект химической реакции (∆Hx.p) равен сумме теплот образования ∆Hобр. продуктов реакции за вычетом суммы теплот образования исходных веществ с учётом коэффициентов перед формулами этих веществ в уравнении реакции:
(1)
В термохимических уравнениях указывают значение энтальпии химической реакции ∆Hx.p. При этом у формулы каждого вещества указывают его физическое состояние: газообразное (г), жидкое (ж), твёрдое кристаллическое (к).
В термохимических уравнениях тепловые эффекты реакций дают в расчёте на 1 моль исходного или конечного вещества. Поэтому здесь допускаются дробные коэффициенты. При химических реакциях проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации) - уменьшению H, а с другой стороны- к беспорядку (дезагрегации). Первая тенденция растёт с понижением температуры, а вторая - с её повышением. Тенденцию к беспорядку характеризует величина, названная энтропией S[Дж/(моль∙K)]. Она является мерой неупорядоченности системы. Энтропия пропорциональна количеству вещества и возрастает с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, ослаблении или разрыве связей между атомами и т. п.
Процессы, связанные с упорядоченностью системы: конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т. п. - ведут к уменьшению энтропии. Энтропия-функция состояния, т. е.
. (2)
Общая движущая сила процесса складывается из двух сил: стремление к упорядочению(∆H) и стремления к беспорядку (S). При p=const и T=const общую движущую силу процесса (∆G) можно представить следующим образом:
.
Энергия Гиббса ∆G, или изобарно-изотермический потенциал, также подчиняется следствию закона Гесса:
.
Слайд 99
Самопроизвольно протекают процессы, идущие в сторону уменьшения любого
потенциала и, в частности, в сторону уменьшения ∆G. При
состоянии равновесия ∆G=0; ∆H=T∆S температура начала равновесной реакции равна:
Стандартные теплоты образования ΔН0298 некоторых веществ (энтальпии)
Слайд 100
Пример 1. Возможно ли осуществление процесса восстановления металлического
железа из оксида Fe2O3 действием
водорода при стандартных условиях,
ответ
обоснуйте, предварительно рассчитав ∆Hº и ∆Sº реакции. При решении задач этого раздела см. таблицы.
Решение: Записываем уравнение реакции:
Из таблиц термодинамических величин берут значения ∆Hº298 и Sº298 для всех веществ, участвующих в реакции, учитывая, что ∆H простых веществ равны нулю.
По закону Гесса вычисляют ∆Hºx.p:
Аналогично вычисляют ∆Sº298, учитывая, что Sº простых веществ не равны нулю.
т. к. ∆Hº и ∆Gº измеряются в кДж/моль, то значение ∆Sº переводят в кДж/моль∙k.
По формуле ∆Gк.р= ∆Hº- T∙∆Sº вычисляют ∆Gк.р
Положительное значение ∆G º(∆Gº>0) указывает на невозможность восстановления Fe2O3 водородом в стандартных условиях.
Слайд 101
Стандартная энергия Гиббса образования
ΔG°298 некоторых веществ

Пример 2. При взаимодействии кристаллов хлорида фосфора (V)
с парами воды образуется жидкий РОCI3 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции,
Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp , равные изменению энтальпии системы ∆Н. Значение ∆Н приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состоянии веществ: г - газообразное, ж - жидкое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно. Если в результате реакции выделяется теплота, то ∆H< О. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
РСI5(к)+Н2О(г)=РОСI3(ж) +2НСI(г); ∆НХ.Р = -111,4кДж.
Слайд 102
Пример 3. Реакция горения этана выражается термохимическим

уравнением:
С2Н6(г) +3 1/2О2 = 2С02 (г) +ЗН2О(ж);
НХ.Р = -1559,87 к Дж.
Вычислите теплоту образовании этана, если известны теплоты образования CO2(г) и Н2О (ж) ( см.табл.).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т.е. 25°С (298 К) и 1,013∙105 Па, и обозначают через ∆Hº298. Так как тепловой эффект с температурой изменяется незначительно, то здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через ∆H. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид:
2 С (графит) +ЗН2 (г) = С2Н6(г); ∆H =?
исходя из следующих данных:
а) С2Н6 (г)+31/2О2 (г) = 2СО2 (г) + ЗН20(ж);
∆H = -1559,87 кДж;
б) С (графит) + О2 (г) = СО2 (г); ∆H = -393,51 кДж;
в) Н2(г) + 1/2О2 = Н2О (ж); ∆H -285,84 кДж.
На основании закона Гесса с термохимическими уравнениями
можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) — на 3, а затем сумму этих уравнений вычесть из уравнения (а):
С2Н6+ 31/2О2 -2С- 2О2- ЗН2- 3/2О2=2 СО2+ЗН2О-2СО2-ЗН2О
∆Н = -1559,87 -2(-393,51) - 3 (-285,84) = +84,67 кДж;
∆Н = -1559,87 + 787,02 + 857,52; С2Н6 = 2С + ЗН2 ;
∆Н = +84,67 кДж.
Так как теплота образования равна теплоте разложения с обратным знаком, то
К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
Учитывая, что теплоты образования простых веществ условно приняты равными нулю
= 2 (-393,51) +3 (-285,84) + 1559,87 = -84,67;
= -84,67 кДж.
Слайд 103
. Химическое сродство
Пример 1.

В каком состоянии энтропии 1 моль вещества больше: в
кристаллическом или в парообразном при той же температуре?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определённых точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше, чем объём 1 моль кристаллического вещества; возможность хаотического движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
CH4 (г) + CO2 (г) ⇄ 2CO (г) + 2H2(г)
Решение. Для ответа на вопрос следует вычислить ∆G0 289 прямой реакции. Значения ∆G0 289 соответствующих веществ приведены в таблице 6. Зная, что ∆G есть функция состояния и что ∆G для находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим ∆G289 процесса:
∆G0 289 = 2 (- 137,27) + 2 (0) – (50,79 – 394,38) = +170,63 кДж.
То что ∆G0 289 > 0 указывает на невозможность самопроизвольного протекания прямой реакции при Т= 289 К и равенстве давлений взятых газов 1,013 · 105 Па (760 мм рт. ст.= 1 атм.).
Пример 3. На основании стандартных теплот образования (табл. и абсолютных стандартных энтропии веществ (табл. ) вычислите ∆Gº298 реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г)
Решение. ∆Gº= ∆Нº – T∆Sº; ∆Н и ∆S — функции состояния,
поэтому ∆HºХ.Р = ∑∆ Hºпрод - ∑∆ Hºисх
∆SºХ.Р=∑∆ Sºпрод - ∑∆ Sºисх.
∆HºХ.Р = (-393,51 +0)- (-110,52- 285,84) = +2,85 кДж;
∆SX.P.=(213,65 + 130,59) - (197,91 + 69,94) = +76,39Дж/(моль·К) = 0,07639 Дж/(моль∙К);
∆G°=+2,85- 298 ·0,07639= -19,91 кДж.
Слайд 104
Стандартные абсолютные энтропии Sº298 некоторых веществ
Пример 4. Реакция восстановления Fe2О3 водородом протекает по уравнению:
Fе2О3(к) + ЗН2 (г) = 2Fе(к) + ЗН2О(г) ; ∆Н= +96,61 кДж.
Возможна ли эта реакция при стандартных условиях,
если изменение энтропии ∆S = 0,1387кДж/(моль∙К)? При какой температуре начнется восстановление Fе2О3?
Решение. Вычисляем ∆G° реакции:
∆G° = ∆Н - T∆S = 96,61 – 298 · 0,1 387 = +55,28 кДж.
Так как ∆G > О, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия) . Найдем температуру, при которой ∆G = 0:
∆Н = T∆S; T=∆Н/∆S = 96,61/0,1387 = 696,5K.
Следовательно, при температуре ≈ 696,5 К начнется реакция восстановления Fе2О3. Иногда эту температуру называют температурой начала реакции.
Слайд 105
Пример 5. Вычислите ∆H°,∆S° и ∆G°Т реакции, протекающей
по уравнению:
Fе2О3(к) + ЗC=2Fе+ ЗCО
Возможна ли реакция восстановления
Fе2О3 углеродом при температурах 500 и 1000 К?
Решение: :: ∆H°X.P. и ∆S°X.P. находим из соотношений (1) и (2) так же, как в примере 3:
∆H°X.P=[3 (-1 10,52) + 2·0]- [-822,10 + 3∙0] = -331,56 + 822,10 =
+490,54 кДж;
∆S°X.P = (2∙27,2 + 3·197,91) - (89,96 + 3∙5,69) = 541,1 Дж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения ∆G°Т =∆Н° -T∆S;
∆G°500 = 490,54 - 500·541,1/1000 = + 21 9,99 кДж;
∆G°1000 = 490, 54 - 1000∙541,1/1000= - 50,56 кДж.
Так как ∆G500 >0, а ∆G1000 < 0, то восстановление Fе2О3 углеродом возможно при 1000 К и невозможно при 500 К.
Слайд 106
Химическое равновесие.

А +В = С
Химическая кинетика-учение о скорости химических реакций. Скорость химической реакции измеряют по изменению молярной концентрации одного из реагирующих веществ в единицу времени. Скорость химической реакции зависит:
1. Oт природы реагирующих веществ, концентрации, температуры и действия катализатора. Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс: скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ
где-
скорость реакции;
- молярные концентрации реагирующих веществ; m и n коэффициенты в уравнении реакции; K-константа скорости реакции, зависящая от природы реагирующих веществ и температуры. Количественная зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
где Т2 и Т1 - температура реакции;
и
скорости реакции при данных температурах,
-температурный коэффициент.
Экзотермическая реакция Эндотермическая реакция
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
Энергетическая диаграмма химической реакции
Слайд 107
2. От поверхности соприкосновения реагирующих веществ. Для гетерогенных

систем (когда вещества находятся в разных агрегатных состояниях), чем
больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
3. От энергии активации
Скорость химической реакции зависит от энергии ее активации. Эта энергия необходима для эффективного соударения молекул (частиц), приводящего к их взаимодействию.
Энергия активации (Еа) - энергия, необходимая для достижения системой переходного состояния, называемого активированным (или переходным) комплексом, который превращается в продукты реакции уже самопроизвольно
Изменение энергии в ходе реакции
Энергия активации Еа равна разности энергий переходного и исходного состояний: Еа = Еперех. сост. - Еисх. сост.
Чем меньше энергия активации реакции, тем выше ее скорость. Эта зависимость выражается уравнением Аррениуса, которое связывает константу скорости реакции k с Еа:
Слайд 108
Катализ
Катализ - изменение скорости химической

реакции в присутствии веществ, которые, участвуя в реакции, к
моменту окончания процесса остаются количественно неизменными.
Вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается называется катализатором.
Катализ называется положительным, если скорость реакции увеличивается, и отрицательным, если скорость уменьшается. При гомогенном катализе реагенты и катализатор находятся в одной фазе (жидкой или газообразной), при гетерогенном катализе - в разных фазах (например, катализатор в твердом состоянии, а реагенты - в жидком или газообразном).
Механизм действия катализаторов, ускоряющих реакцию, связан с тем, что они снижают энергию активации реакции за счет образования промежуточных соединений с реагирующими веществами (каталитических комплексов), обладающих меньшей энергией:
Резко замедлить протекание нежелательных химических процессов, в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
Химическое равновесие
Состояние равновесия характерно для обратимых химических реакций.
Обратимая реакция - химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях.
Необратимой называется реакция, которая идет практически до конца в
одном направлении. Примеры:
Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются.
Для одностадийной обратимой реакции
при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют вид:
где [А], [В], [С] и [D] - равновесные молярные концентрации веществ A, B, C и D;
a,b,c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию);
Слайд 110
k1 и k2 -коэффициенты пропорциональности, называемые константами скоростей.
Из

условия равновесия V1 = V2 следует:
Отсюда получаем выражение
для константы равновесия kp:
Чем выше величина kp, тем больше в равновесной смеси продуктов прямой реакции.
Смещение равновесия в нужном направлении достигается изменением условий реакции (принцип Ле-Шателье).
Большинство химических реакций обратимы. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия. Для равновесной системы
mA + nB ⇄ pC + gD
математическое выражение закона действия масс имеет вид
В такой форме закон действующих масс для обратимой реакции применим только в том случае, если система гомогенна. Реакции, в которых кроме газообразных и растворённых веществ участвуют также твёрдые вещества, происходят на поверхности твёрдого вещества, площадь которого практически не меняется. В этом случае концентрация твёрдого вещества принимается за постоянную величину и не входит в выражение скорости химической реакции и, следовательно, в выражение константы равновесия. В таких реакциях скорость зависит только от концентрации газообразных или растворённых веществ.
Изменение условий существования химического равновесия (температура, концентрация реагирующих веществ, давление) вызывает смещение химического равновесия. Направление, в котором смещается равновесие , определяется принципом Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
Слайд 111
1. Увеличение давления (для газов) смещает равновесие в

сторону реакции, ведущей к уменьшению объема (т.е. к образованию
меньшего числа молекул) и наоборот, уменьшение давления смещает равновесие в сторону реакции, ведущей к увеличению объема, (т.е. к образованию большего числа молекул).
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты) и наоборот, уменьшение температуры смещает положение равновесия в сторону экзотермической реакции, (т.е. в сторону реакции, протекающей с выделением теплоты).
3. Увеличение концентрации исходных веществ или удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Уменьшение концентраций исходных веществ равновесие смещает в сторону исходных веществ.
4. Катализаторы не влияют на положение равновесия.
Пример 1. Как изменится скорость прямой и обратной реакции:
N2 (Г) + 3H2 (г) ⇄ 2NH3 (г)
если объём газовой смеси уменьшить в два раза? В какую сторону сместится равновесие системы?
Решение: Примем обозначения:
- концентрации до изменения объёма. Согласно закону действующих масс,
вследствие уменьшения объёма в 2 раза концентрация каждого из реагирующих веществ увеличится в два раза. Следовательно,
=
,
Отсюда
Равновесие системы сместилось в сторону образования аммиака.
Слайд 112
Пример 2. Исходные концентрации йода и водорода
равны соответственно 1 и 2 моль/дм3. Вычислите равновесные концентрации
веществ при 450º С, если при этой температуре для реакции: H2+I2=2HI константа химического равновесия K=50.
Решение. Обозначим через
и
равновесные концентрации йода и водорода (в моль/дм3). Пусть к моменту установления равновесия прореагировало количество (моль/дм3 ) водорода, равное X . Так как столько же прореагирует и йода, то количество образовавшегося йодистого водорода будет равно 2X. Равновесная концентрация йода будет равна 1-X, а равновесная концентрация водорода -2-X. Для данной обратимой реакции закон действующих масс выражается через константу равновесия:
Отсюда X=0,93
Ответ: Равновесные концентрации веществ при 450º C:
моль/дм3;
Слайд 113
Пример 3. Во сколько раз изменится скорость
прямой и обратной реакции в системе:
2SO2 (г) + O2 (г) ⇄ 2SO3(г)
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]= а, [O2] = b, [SO3]= с. Согласно закону действия масс скорости v рямой и обратной реакции до изменения объема
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [O2] =3b; [SO3] = 3с. При новых концентрациях скорости V’ прямой и обратной
реакции:
= K(3a)2(3b)=27Ka2b; v´обр= K 1(3с)2=9K 1с2
Отсюда:
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной -только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Слайд 114
Пример 4. Вычислите, во сколько
раз увеличится скорость реакции, протекающей в газовой фазе, при
повышении температуры от 30 до 70 С0, если температурной коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
Следовательно, скорость реакции
при температуре 700 С больше скорости реакции
при температуре 300 С в 16 раз.
Слайд 115
Пример 5. Константа равновесия гомогенной системы

СО (г) + Н2О (г) ⇄
СО2 (г) + Н2 (г)
при 8500С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО] ИСХ = 3 моль/л, [Н2О]ИСХ =2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
= К1 [CO]· [H20];
= К2[С02] ∙[Н2 ];
В условии задачи даны исходные концентрации, тогда как в выражение КР входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [С02]Р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ
[С02]Р = [Н2 ]Р = х моль/л;
[СО]Р = (3-х) моль/л;
[Н2О]р = (2-х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные кон- центрации всех веществ
х = 6- 2х – 3х + х2
5x =6, x =1,2 моль/л.
Таким образом, искомые равновесные концентрации:
[С02]Р = 1,2 моль/л;
[Н2 ]Р = 1,2 моль/л;
[СО]Р = 3- 1,2 = 1,8 моль/л;
[Н2О]р =2 -1,2= 0,8 моль/л.
Слайд 116
Пример 6. Эндотермическая реакция

разложения пентахлорида фосфора протекает по уравнению
РСI5 (г) ⇄ РСI3
(г) + CI2 (г); ∆H = + 92,59 кДж.
как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РСI5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РСI5 эндотермическая (∆H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или СI2.
способы выражения концентрации растворов.
Растворами называют гомогенные системы, состоящие из растворенного вещества, растворителя и продуктов их взаимодействия. Основной характеристикой раствора является его состав, который выражается концентрацией.
Концентрацией раствора называется содержание растворенного вещества в определенном количестве или объеме раствора или растворителя.Существует два метода выражения концентрации растворов: Через безразмерную величину – доли (массовая доля, молярная доля). Через размерные величины – молярные массы.
Массовая доля вещества А (
(А) омега) – это отношение массы вещества (
(А)) к массе раствора (
р ра).
Измеряется в долях единицы. Часто этот вид концентрации выражают в процентах и называют процентной концентрацией.
Массовая доля данного вещества, выраженная в процентах, показывает, сколько граммов вещества содержится в 100г раствора. Например: 10% р-р NaCl – это значит, в 100г раствора содержится 10г NaCl и 90г H2O.
РАСТВОРЫ
Слайд 118
Молярная доля растворенного вещества (N(А))
– это отношение числа моль растворенного вещества (n(A)) к
сумме моль растворенного вещества и растворителя (n(B)).
где n – число моль вещества,
А – растворенное вещество,
В – растворитель.
Молярная доля растворителя (N(В)) – это отношение числа моль растворителя (n(В)) к сумме числа моль растворителя и растворенного вещества. (n(В)).
Основной единицей количества вещества – n (A) – является моль.
Моль – это количество вещества, которое содержит столько структурных единиц (атомов, молекул, ионов и т. д.), сколько атомов содержится в 12г углерода С12. 1 моль вещества содержит
элементарных объектов – число Авогадро.
. Масса вещества
, его молярная масса M (A) и количество n (A) связаны отношением:
или
Слайд 119
Молярная масса вещества M (A) характеризует массу одного
моль вещества.
Молярная концентрация
- это отношение количества растворенного вещества n (A) к объему его раствора (V).
(1 дм3 = 1 л).
показывает, сколько моль растворенного вещества содержится в 1 (1 л) раствора.
Так- как
, то
, 1 дм3 = 1000 см3 ,
1 л = 1000 мл, 1 см3 = 1 мл..
Зная , можно вычислить массу растворенного вещества в заданном объеме раствора:
(г).
Слайд 120
Растворы с молярной концентрацией называются молярными растворами.
- одномолярный раствор.
- децимолярный раствор.
- сантимолярный раствор.,
- миллимолярный раствор.
0,1 м - децимолярный раствор,
буквой “ ” обозначается “молярный” раствор.
0,04 м – четырехсантимолярный раствор.
2 м – двумолярный раствор.
Молярная концентрация эквивалента или эквивалентная концентрация С
или
- это число моль эквивалента вещества, содержащееся в
раствора.
Число моль эквивалента вещества определяется формулой:
где
- фактор эквивалентности вещества.
М (А) – молярная масса вещества.
или
Слайд 121
Условно применяются следующие обозначения:
или 1н раствор–однонормальный раствор.
или

2 н
- двунормальный раствор серной кислоты.
или 0,5 н – пятидецинормальный раствор хлорида меди.
Если численные значения молярной и эквивалентной концентрации совпадают, т. е. Z = 1, то употребляют слово “молярный”. Например, для 2М раствора NaOH, , 2М раствора HCI не нужно применять выражение 2н NaOH, 2н HCI.
Часто на практике молярную концентрацию эквивалента называют нормальной концентрацией и говорят: нормальность раствора равна, например, 2 (двум), т.е. 2н. В современной интерпретации это означает:
Моляльная концентрация
- число моль вещества, содержащееся в 1 кг растворителя.
или
где n (A) – количество вещества А,
m (A) – масса растворенного вещества (г),
М (А) – молярная масса вещества А (г/моль),,
m(р-ля) - масса растворителя (г).
Титр Т(А) – определяется отношением массы растворенного вещества (А) к объему его раствора.
или
Титр показывает, сколько граммов растворенного вещества содержится в 1 см3 (1 мл) раствора.
Слайд 122
Например,
Это значит, в 1 см3 раствора содержится
0,08 г
Плотность раствора ( ) –
отношение массы раствора к его объему.
, т.е.
показывает, какова масса 1 см3 раствора.
Например,
Это значит, масса 1 см3 раствора равна 1,108г.
Дано:
, V = 200 см3 Найти массу раствора.
Слайд 123
В практике приготовления растворов и при решении задач

можно пользоваться формулами пересчета одной концентрации в другую.
или
т.к.
то
.
Для определения концентрации уже готового реактива существует несколько способов. Среди них простыми в выполнении и достаточно точными являются объемные методы, основанные на реакциях между электролитами, которые протекают до конца. По типу реакции объемные методы могут быть разбиты на две группы, объединяющие: I) определения, основанные на реакциях соединения ионов (метод нейтрализации и метод осаждения и комплексообразования) и II) определения, основанные на реакциях передачи электронов от одного атома или иона к другому (т. е. разнообразные реакции окисления-восстановления).
Сущность основного приема объемного метода – титрования, заключается в том, что к точно отмеренному объему определяемого раствора постепенно приливают из бюретки рабочий раствор с точно известной концентрацией до тех пор, пока не достигнут точки эквивалентности.
Точку эквивалентности регистрируют по различным признакам: по изменению окраски титруемого раствора, по выпадению осадка, а чаще всего, по изменению окраски индикатора. В тех случаях, когда растворы в эквивалентной точке своей окраски не изменяют, в раствор вводят вспомогательные вещества – индикаторы, по изменению окраски которых судят о завершении реакции. После титрования измеряют по бюретке объем рабочего раствора, затраченного на реакцию и делают расчеты.
В эквивалентной точке количества прореагировавших веществ пропорциональны их эквивалентам, благодаря чему можно произвести необходимые вычисления.
Слайд 124
При определении концентрации методом титрования пользуются законом эквивалентов:

или
Пример1. Сколько воды надо прибавить
к 200 см3 68 % раствора азотной кислоты с плотностью
чтобы получить 10 % раствор.
Решение. Находим массу исходного раствора.
Находим массу азотной кислоты в исходном растворе.
т.к. 2-й раствор приготовлен методом разбавления, то содержание азотной кислоты в первом и втором растворах одно и то же. Зная, что концентрация второго раствора 10 % и в нем содержится 190,4 г азотной кислоты, найдем массу второго раствора.
Находим массу добавленной воды
Найдем объем добавленной воды, зная что
Правило креста. На практике растворы готовятся также методом разбавления или смешиванием двух растворов различной концентрации. В этом случае для вычисления массовых или объемных отношений между растворами пользуются графическим методом или “правилом креста”. Для этого в левом верхнем углу записывается большая концентрация, в левом нижнем – низшая концентрация, в центре – требуемая концентрация. В правой части путем вычитания получаются весовые отношения исходных растворов.
Общая формула “правила креста“
- масса раствора с массовой долей
- масса раствора с массовой долей
Приведенная выше задача может быть решена и “правилом креста”.
Решение: Соответствующая воде массовая доля принимается равной нулю. На 10 весовых частей 68 % раствора азотной кислоты необходимо взять 58 весовых частей воды. Перейдем к объемным отношениям, используя плотности растворов.
68 10 весовых частей 68 % раствора.
10
0 58 весовых частей воды надо прибавить
Cоставляем пропорцию:
надо прибавить
К 200 см3 — X.
, X = 1624 см3.
Слайд 126
Пример.2. Приготовить 100 см3 раствора KOH с массовой
долей
5 % из раствора KOH с массовой долей
40 % и воды. Какие объемы воды и исходного раствора надо взять?
Решение: Составляем диагональную схему:
40 5 весовых частей 40 % раствора.
5
0 3 5 весовых частей воды.
Находимые объемы:
Находим объем 40 % раствора, необходимый для приготовления 100
Находим объем воды
Слайд 127
Пример3. Сколько грамм сульфата алюминия потребуется для
приготовления 500 см3 0,3 н р-ра?
Решение:
Запишем формулу эквивалентной концентрации:
Z = 6
Объем переводим в дм3.
Пример 4. Найти молярную, эквивалентную, моляльную концентрации и титр раствора серной кислоты с массовой долей 20 % и
Решение. Воспользуемся формулами пересчета.
или
s-, p-, d-элементы
Положение металлов в периодической таблице
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены
в начале периодов (начиная со второго).
Виды кристаллических решеток
атомная ионная металлическая
ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ
Кристаллические решетки металлического типа содержат в узлах положительно заряженные ионы и нейтральные атомы; между ними
передвигаются относительно свободные электроны.
Слайд 129
Общие физические свойства
Объясняются особым строением кристаллической решетки -

наличием свободных электронов ("электронного газа").
1) Пластичность - способность
изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду - Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду - Ag,Cu,Al,Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение
"электронного газа".
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый –
осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3, считаются "легкими металлами".
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Слайд 130
Общие химические свойства металлов
Металлы
сильные восстановители: Me0 – ne=> Men+
I.
Реакции с неметаллами
1) С кислородом: 2Mg0 + O2 => 2Mg+2 O
2) С серой: Hg0 + S => Hg+2 S
3) С галогенами: Ni + Cl2 => Ni+2Cl2
4) С азотом: Ca0 + N2 => Ca3+2N2
5) С фосфором: Ca0 + 2P => Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li0 + H2 => 2Li+1H
Ca0 + H2 => Ca+2H2
II. Реакции с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg0 + 2HCl => Mg+2Cl2 + H20
(Mg0 + 2H+ => Mg2++ H20)
2Al0+ 6HCl => 2AlCl3 + 3H20
(2Al0 + 6H+ => 2Al3+ + 3H20)
6Na0 + 2H3PO4 => 2Na3+1PO4 + 3H2
(6Na0 + 6H+ => 6Na+ + 3H20)
Восстановление металлами кислот-окислителей смотри в разделах: "окислительно-восстановительные реакции", "серная кислота", "азотная кислота".
Слайд 131
III. Взаимодействие с водой
1) Активные (щелочные и
щелочноземельные металлы) образуют растворимое основание и водород:
2Na0 +
2H2O => 2Na+1OH + H20
(2Na0 + 2H2O => 2Na1+ + 2OH1- + H20)
Ca0 + 2H2O => Ca+2(OH)2 + H20
(Ca0 + 2H2O => Ca2+ + 2OH1- + H20)
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn0 + H2O => Zn+2O + H02
3) Неактивные (Au, Ag, Pt) - не реагируют.
4) Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu0 + Hg+2Cl2 => Hg0 + Cu+2Cl2
(Cu0 + Hg2+ => Cu2+ + Hg0)
Fe0 + Cu+2SO4 => Cu0 + Fe+2SO4
(Fe0 + Cu2+ => Cu0 + Fe2+)
Слайд 132
Подгруппа алюминия
Свойства элементов подгруппы алюминия
Физические свойства
1.
С увеличением атомной массы усиливается металлический характер
элементов (В – неметалл; остальные – металлы).
2. Бор значительно отличается по свойствам от других элементов (высокие т.пл., т.кип., твердость; инертность). Остальные элементы – легкоплавкие металлы, In и Tl - очень мягкие.
Слайд 133
Химические свойства
1. Все элементы трехвалентны, но с

повышением атомной массы приобретает значение валентность, равная единице (Tl
в основном одновалентен).
2. Основность гидроксидов R(OH)3 возрастает с увеличением атомной массы (H3BO3 - слабая кислота, Al(OH)3 и Ga(OH)3 - амфотерные основания, ln(OH)3 и Tl(OH)3 -типичные основания, TlOH - сильное основание).
3. Металлы подгруппы алюминия (Al, Ga, In, Tl) химически достаточно активны (реагируют с кислотами, щелочами (Al, Ga), галогенами).
4. Соли элементов подгруппы алюминия в большинстве случаев подвергаются гидролизу по катиону. Устойчивы лишь соли одновалентного таллия.
5. Al и Ga защищены тонкой оксидной пленкой; Tl разрушается при действии влажного воздуха, (хранят в керосине).
Алюминий
Al
Открыт Х.К.Эрстедом в 1825 г.
Четвертый по распространённости элемент в земной коре.
Физические свойства
Серебристо-белый металл, (r=2,7 г/см3), пластичный, высокая тепло- и электропроводность.
t°пл.= 660°C.
Нахождение в природе
Бокситы – Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3),
нефелины – KNa3[AlSiO4]4,
алуниты - KAl(SO4)2 • 2Al(OH)3 и
глиноземы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3).
Слайд 134
Получение
Электролиз расплава Al2O3 (в присутствии криолита Na3[AlF6]):
2Al2O3 =>
![Химия ПолучениеЭлектролиз расплава Al2O3 (в присутствии криолита Na3[AlF6]): 2Al2O3 => 4Al +](/img/tmb/11/1077522/5bcbb7bb136344d714fdf057c437fe71-720x.jpg)
4Al + 3O2
Химические свойства
Al – покрыт тонкой и прочной
оксидной пленкой (не реагирует с простыми веществами: с H2O (t°); O2, HNO3 (без нагревания)).
Al – активный металл-восстановитель.
Легко реагирует с простыми веществами:
1) С кислородом: 4Al0 + 3O2 => 2Al+32O3
2) С галогенами: 2Al0 + 3Br20 => 2Al+3Br3
3) С другими неметаллами (азотом, серой, углеродом) реагирует при нагревании:
2Al0 + 3S –t° => Al2+3S3(сульфид алюминия)
2Al0 + N2 –t°=> 2Al+3N(нитрид алюминия)
4Al0 + 3С => Al4+3С3(карбид алюминия)
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O => 2Al(OH)3¯ + 3H2S
Al4C3 + 12H2O => 4Al(OH)3¯+ 3CH4
Со сложными веществами:
4) С водой (после удаления защитной оксидной пленки):
2Al0 + 6H2O => 2Al+3(OH)3 + 3H2
5) Со щелочами:
2Al0 + 2NaOH + 6H2O => 2Na[Al+3(OH)4] (тетрагидроксоалюминат натрия) + 3H2
6) Легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl => 2AlCl3 + 3H2
2Al + 3H2SO4 (разб) => Al2(SO4)3 + 3H2
При нагревании растворяется в кислотах - окислителях:
2Al + 6H2SO4 (конц) => Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3 (конц) => Al (NO3)3 + 3NO2 + 3H2O
7) Восстанавливает металлы из их оксидов (алюминотермия):
8Al0 + 3Fe3O4 => 4Al2O3 + 9Fe
2Al + Cr2O3 => Al2O3 + 2Cr
Слайд 135
Применение
Основа легких и прочных сплавов. Раскислитель стали. Используется
для получения ряда металлов алюминотермией.
Оксид алюминия
Al2O3
O=Al–O–Al=O
Глинозем, корунд, окрашенный
– рубин (красный), сапфир (синий).
Твердое тугоплавкое (t°пл.=2050°С) вещество; существует в нескольких кристаллических модификациях (a – Al2O3, g – Al2O3).
Получение
4Al + 3O2 => 2Al2O3
2Al(OH)3 => Al2O3 + 3H2O
Амфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1) Реагирует с кислотами и растворами щелочей:
Как основной оксид:
Al2O3 + 6HCl => 2AlCl3 + 3H2O
Как кислотный оксид:
Al2O3 + 2NaOH + 3H2O => 2Na[Al(OH)4]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al2O3 + Na2CO3 => 2NaAlO2(алюминат натрия) + CO2
Al2O3 + 2NaOH => 2NaAlO2 + H2O
Слайд 136
Гидроксид алюминия
Al(OH)3
Получение
1) Осаждением из растворов солей щелочами
или гидроксидом аммония:
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al2(SO4)3
+ 6NH4OH → 2Al(OH)3↓ + 3(NH4)2SO4
Al3+ + 3OH- → Al(OH)3↓(белый студенистый)
2) Слабым подкислением растворов алюминатов:
Na[Al(OH)4] + CO2 → Al(OH)3↓ + NaHCO3
Амфотерный гидроксид:
Как основание Al(OH)3 + 3HCl → AlCl3 + 3H2O
Как кислота Al(OH)3 + NaOH → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Подгруппа железа
Свойства элементов подгруппы железа
Слайд 137
Получение
металлов подгруппы железа
Восстановлением из оксидов углём или оксидом
углерода (II)
FeO + C → Fe + CO
Fe2O3
+ 3CO → 2Fe + 3CO2
NiO + C → Ni + CO
Co2O3 + 3C → 2Co + 3CO
Fe
d- элемент VIII группы; порядковый номер – 26; атомная масса – 56; (26p11; 30 n01), 26e
Металл средней активности, восстановитель.
Основные степени окисления - +2, +3
Железо и его соединения.
Химические свойства.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O => 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II,III):
3Fe + 2O2 => Fe3O4
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t° => Fe3O4 + 4H2
3) Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 –t° => 2FeBr3
Fe + S –t° => FeS
4) Железо легко растворяется в соляной и разбавленной серной кислотах:
Fe + 2HCl => FeCl2 + H2
Fe + H2SO4(разб.) => FeSO4 + H2
В концентрированных кислотах–окислителях железо растворяется только при нагревании
2Fe + 6H2SO4 (конц.) –t° => Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 (конц.) –t° => Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 => FeSO4 + Cu¯

Соединения двухвалентного железа
Гидроксид железа (II)
Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха:
FeCl + 2KOH => 2KCl + Fе(OH)2¯
Fe(OH)2 - слабое основание, растворимо в сильных кислотах:
Fe(OH)2 + H2SO4 => FeSO4 + 2H2O
Fe(OH)2 + 2H+ => Fe2+ + 2H2O
При прокаливании Fe(OH)2 без доступа воздуха образуется оксид железа (II) FeO:
Fe(OH)2 –t°=> FeO + H2O
В присутствии кислорода воздуха белый осадок Fe(OH)2, окисляясь, буреет – образуя гидроксид железа (III) Fe(OH)3:
4Fe(OH)2 + O2 + 2H2O => 4Fe(OH)3
Соединения железа (II) обладают восстановительными свойствами, они легко превращаются в соединения железа (III) под действием окислителей:
10FeSO4 + 2KMnO4 + 8H2SO4 => 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
6FeSO4 + 2HNO3 + 3H2SO4 => 3Fe2(SO4)3 + 2NO + 4H2O
Соединения железа склонны к комплексообразованию (координационное число=6):
FeCl2 + 6NH3 => [Fe(NH3)6]Cl2
Fe(CN)2 + 4KCN => K4[Fe(CN)6](жёлтая кровяная соль)
Качественная реакция на Fe2+
При действии гексацианоферрата (III) калия K3[Fe(CN)6] (красной кровяной соли) на растворы солей двухвалентного железа образуется синий осадок (турнбулева синь):
3FeSO4 + 2K3[Fe(CN)6] => Fe3[Fe(CN)6]2¯ + 3K2SO4
3Fe2+ + 3SO42- +6K+ + 2[Fe(CN)6]3- => Fe3[Fe(CN)6]2¯ + 6K+ + 3SO42-
3Fe2+ + 2[Fe(CN)6]3- => Fe3[Fe(CN)6]2¯
Слайд 140
Соединения трёхвалентного железа
Оксид железа (III)
Образуется при сжигании сульфидов

железа, например, при обжиге пирита:
4FeS2 + 11O2 => 2Fe2O3
+ 8SO2
или при прокаливании солей железа:
2FeSO4 –t° => Fe2O3 + SO2 + SO3
Fe2O3 - основной оксид, в незначительной степени проявляющий амфотерные свойства
Fe2O3 + 6HCl –t° => 2FeCl3 + 3H2O
Fe2O3 + 6H+ –t° => 2Fe3+ + 3H2O
Fe2O3 + 2NaOH + 3H2O –t° => 2Na[Fe(OH)4]
Fe2O3 + 2OH- + 3H2O => 2[Fe(OH)4]-
Гидроксид железа (III)
Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка
Fe(NO3)3 + 3KOH => Fe(OH)3¯ + 3KNO3
Fe3+ + 3OH- => Fe(OH)3¯
Fe(OH)3 – более слабое основание, чем гидроксид железа (II).
Это объясняется тем, что у Fe2+ меньше заряд иона и больше его радиус, чем у Fe3+, а поэтому, Fe2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH)2 более легко диссоциирует. В связи с этим соли железа (II) гидролизуются незначительно, а соли железа (III) - очень сильно. Для лучшего усвоения материалов этого раздела рекомендуется просмотреть видеофрагмент (доступен только на CDROM). Гидролизом объясняется и цвет растворов солей Fe(III): несмотря на то, что ион Fe3+ почти бесцветен, содержащие его растворы окрашены в жёлто-бурый цвет, что объясняется присутствием гидроксоионов железа или молекул Fe(OH)3, которые образуются благодаря гидролизу:
Fe3+ + H2O ⬄ [Fe(OH)]2+ + H+
[Fe(OH)]2+ + H2O ⬄ [Fe(OH)2]+ + H+
Fe(OH)2]+ + H2O ⬄ Fe(OH)3 + H+
При нагревании окраска темнеет, а при прибавлении кислот становится более светлой вследствие подавления гидролиза. Fe(OH)3 обладает слабо выраженной амфотерностью: он растворяется в разбавленных кислотах и в
концентрированных растворах щелочей:
Fe(OH)3 + 3HCl => FeCl3 + 3H2O
Fe(OH)3 + 3H+ => Fe3+ + 3H2O
Fe(OH)3 + NaOH => Na[Fe(OH)4]
Fe(OH)3 + OH- => [Fe(OH)4]-
Соединения железа (III) - слабые окислители, реагируют с сильными восстановителями:
2Fe+3Cl3 + H2S-2 => S0 + 2Fe+2Cl2 + 2HCl
Слайд 141
Качественные реакции на Fe3+
1) При действии
гексацианоферрата (II) калия K4[Fe(CN)6] (жёлтой кровяной соли) на растворы
солей трёхвалентного железа образуется синий осадок (берлинская лазурь):
4FeCl3 +3K4[Fe(CN)6] => Fe4[Fe(CN)6]3¯ + 12KCl
4Fe3+ + 12Cl- + 12K+ + 3[Fe(CN)6]4- => Fe4[Fe(CN)6]3¯ + 12K+ + 12Cl-
4Fe3+ + 3 [Fe(CN)6]4- => Fe4[Fe(CN)6]3¯
2) При добавлении к раствору, содержащему ионы Fe3+ роданистого калия или аммония появляется интенсивная кроваво-красная окраска роданида железа(III):
FeCl3 + 3NH4CNS ⬄ 3NH4Cl + Fe(CNS)3
(при взаимодействии же с роданидами ионов Fe2+ раствор остаётся практически бесцветным).
Кобальт и его соединения
По химической активности кобальт уступает железу. Он легко растворяется в кислотах - окислителях и медленно в обычных кислотах:
Co + 2HCl => CoCl2 + H2
В простых соединениях у кобальта наиболее устойчива степень окисления +2, в комплесных – +3. Водные растворы солей кобальта (II) обычно окрашены в розовый цвет.
Гидроксид кобальта (II)
Образуется при действии щелочей на соли кобальта (II):
CoSO4 + 2KOH => K2SO4 + Co(OH)2¯
На воздухе розовый осадок Co(OH)2 постепенно буреет, превращаясь в гидроксид кобальта (III):
4Co(OH)2 + O2 + 2H2O => 4Co(OH)3
Сo(OH)2 - слабое основание, растворимое в сильных кислотах:
Co(OH)2 + 2HCl => CoCl2 + 2H2O
При прокаливании Co(OH)2 образует оксид кобальта (II) CoO:
Co(OH)2 –t°=> CoO + H2O
Cоединения кобальта склонны к комплексообразованию (координационное число=6):
Co(OH)2 + 6NH3 => [Co(NH3)](OH)2
Никель и его соединения
Никель легко растворяется в разбавленной азотной кислоте и медленно в соляной и серной кислотах
Ni + 2HCl => NiCl2 + H2
Ион Ni2+ в водных растворах имеет зелёную окраску. Для никеля наиболее характерна степень окисления +2. Оксид и гидроксид никеля проявляют основной характер.
NiO + H2SO4 –t°=> NiSO4 + H2O
NiCl2 + 2NaOH –t°=> Ni(OH)2¯(зелёный) + 2NaCl
Ni(OH)2 + H2SO4 => NiSO4 + 2H2O
Соединения двухвалентного никеля могут давать комплексы с аммиаком:
Ni(OH)2 + 6NH2 => [Ni(NH3)6](OH)2
Слайд 144
Подгруппа меди
побочная подгруппа I группы
Свойства элементов подгруппы
меди
Физические свойства
1. Высокие значения плотности, температур плавления и кипения.
2.
Высокая тепло- и электропроводность.
Химические свойства
Химическая активность небольшая, убывает с увеличением атомного номера.
Медь и её соединения
Получение
1. Пирометаллургия
CuO + C → Cu + CO
CuO + CO → Cu + CO2
2. Гидрометаллургия
CuO + H2SO4 → CuSO4 + H2O
CuSO4 + Fe → FeSO4 + Cu
3. Электролиз:
2CuSO4 + 2H2O → 2Cu0 + O2 + 2H2SO4
(на катоде) (на аноде)
Слайд 145
Химические свойства
Взаимодействует с неметаллами при высоких температурах:
2Cu
+ O2 => 2CuO
Cu + Cl2 => CuCl2
Медь стоит
в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.) => 3Cu(NO3)2 + 2NO + 2H2O
Cu + 4HNO3(конц.) => Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H2SO4(конц.) => CuSO4 + SO2 +2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
Слайд 146
Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O,

Cu2S, CuCl), либо в виде растворимых комплексов (координационное число
меди – 2):
CuCl + 2NH3 => [Cu(NH3)2]Cl2
Оксид меди (I) - красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH => Cu2O¯ + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди
Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4 => CuSO4 + H2O
CuO + 2HNO3 => Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH => Cu(OH)2 + Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 => CuO + H2O
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl => CuCl2 + 2H2O
Cu(OH)2 + 2H+ => Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3 => [Cu(HN3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O => Cu2(OH)2CO3 + 2Na2SO4 + CO2
Разложение малахита:
Cu2(OH)2CO3 => 2CuO + CO2 + H2O
Слайд 147
Серебро и его соединения
Благородный металл, устойчивый на воздухе.

При потускнении серебра происходит реакция Гепара:
4Ag + 2H2S +
O2 → 2Ag2S + 2H2O
В ряду напряжений находится правее водорода, поэтому растворяется только в кислотах - окислителях:
3Ag + 4HNO3(разб.) → 3AgNO3 + NO + 2H2O
Ag + 2HNO3(конц.) → AgNO3 + NO2+ H2O
2Ag + 2H2SO4(конц.) → Ag2SO4 + SO2 + 2H2O
В соединениях серебро обычно проявляет степень окисления +1.
Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Ag+ + Cl- → AgCl¯ белый
Ag+ + Br- → AgBr¯ светло-жёлтый
Ag+ + I- → AgI¯ тёмно-жёлтый
(Способность этих осадков образовывать растворимые комплексные соединения уменьшаются в ряду AgCl – AgBr – AgI). На свету галогениды серебра постепенно разлагаются с выделением серебра.
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH → Ag2O + 2NaNO3 + H2O
Осадки AgCl и Ag2O растворяются в растворах аммиака с образованием комплексных соединений (координационное число серебра – 2):
AgCl + 2NH3 → [Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]OH
Аммиачные комплексы серебра взаимодействуют с альдегидами (реакция серебряного зеркала):
Слайд 148
Золото и его соединения
Золото - мягче Cu и
Ag, ковкий металл; легко образует тончайшую фольгу; благородный металл,
устойчив как в сухом, так и во влажном воздухе. Растворим только в смеси концентрированных соляной и азотной кислот ("царской водке"):
Au + HNO3 + 4HCl => H[AuCl4] + NO + 2H2O
Реагирует с галогенами при нагревании:
2Au + 3Cl2 => 2AuCl3
Соединения термически не очень устойчивы и разлагаются при нагревании с выделением металла. Комплексообразователь (комплексы золота (III) обладают координационными числами 4, 5 и 6).
Слайд 149
Подгруппа цинка
Свойства элементов II группы
побочной подгруппы (подгруппы цинка)
Физические
свойства
1. Сходство элементов главной и побочной подгрупп во
II группе больше, чем в I группе.
2. Значения плотности r и атомного объема повышаются с увеличением атомной массы.
Химические свойства
1. Химическая активность уменьшается с увеличением атомной массы (в главной подгруппе – наоборот).
2. Хорошие комплексообразователи (в отличие от элементов главной подгруппы).
Слайд 150
Цинк и его соединения
Цинк - металл серебристо-белого цвета.

В соединениях проявляет только одну степень окисления +2; соединения
цинка неокрашены.
Нормальный окислительно-восстановительный потенциал в кислой среде системы Zn2+ / Zn равен -0,76 в, а в щелочной среде системы ZnO22- / Zn равен -1,22 в. Поэтому цинк растворяется в разбавленных кислотах и щелочах
Zn + 2НCl => ZnCl2 + H2
Zn + H2SO4(разб) => ZnSO4 + H2
Zn + 2NaOH + 2H2O => Na2[Zn(OH)4] + H2
Цинк не разлагает воду, т.к. в водном растворе он быстро покрывается защитной пленкой оксида, которая предохраняет его от коррозии.
Цинк - сильный восстановитель и вытесняет менее активные металлы (стоящие справа в ряду напряжений) из растворов их солей
Zn + CuSO4 => ZnSO4 + Cu
Оксид цинка проявляет амфотерный характер, растворяясь как в кислотах, так и в растворах щелочей:
ZnO + H2SO4 => ZnSO4 + H2O
ZnO + 2NaOH + H2O => Na2[Zn(OH)4]
При нагревании комплексный тетрагидроксицинкат-анион дегидратируется:
[Zn(OH)4]2- => ZnO22- + 2H2O
Гидроксид цинка также проявляет амфотерные свойства. Он нерастворим в воде, но растворяется в кислотах и щелочах;
Zn(OH)2 + 2HCl => ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH ® Na2[Zn(OH)4]
Ион Zn2+ является энергичным комплексообразователем с координационным числом 4. В отличие от гидроксида алюминия гидроксид цинка растворяется в водном растворе аммиака:
Zn(OH)2 + 2NH3 => [Zn(NH3)4](OH)2
Слайд 151
Кадмий и его соединения
Кадмий - белый,
блестящий, мягкий, ковкий металл; очень мало растворяется в неокисляющих
кислотах, хорошо растворяется в разбавленной HNO3 (нормальный потенциал Cd / Cd 2+ = -0,40 в).
1.Кадмий образует только один ряд соединений, где он двухвалентен.
Ион Сd2+- бесцветен.
2.Оксид кадмия СdО (коричневого цвета) и гидроксид кадмия Сd(ОН)2 (белого цвета) проявляют основной характер, растворяясь только в кислотах.
CdO + 2HCl => CdCl2 + H2O
(CdO + 2H+ => Cd2+ + H2O)
Cd(OH)2 + 2HCl => CdCl2 + 2H2O
(Cd(OH)2 + 2H+ => Cd 2+ + 2H2O)
3.Кадмий является хорошим комплексообразователем (координационное число 4 для Cd2+ и 6 для Сd3+).
4). Гидроксид кадмия растворяется в водном растворе аммиака:
Cd(OH)2 + 4NH3 => [Cd(NH3)4](OH)2
Слайд 152
Ртуть и ее соединения
Ртуть -

серебристо-белый, блестящий, единственный жидкий при комнатной температуре металл; обладает
низкой электропроводностью (она составляет 1,7% от электропроводности серебра) и большим коэффициентом термического расширения. На воздухе проявляет устойчивость. Реагирует с серой и галогенами:
Hg + S => HgS
Hg + Br2 => HgBr2
Со многими металлами дает сплавы (амальгамы) (экзотермическое образование). Пары и соединения чрезвычайно ядовиты (накапливаются в организме).
Ртуть не растворяется в соляной и разбавленной серной кислотах (в ряду напряжений металлов ртуть находится после водорода; нормальный
потенциал Hg / Hg 2+ = +0,85 в). Ртуть легко растворяется в концентрированной азотной кислоте – образуется нитрат ртути (II):
Hg + 4HNO3 => Hg(NO3)2 + 2NO2 + 2H2O
При растворении ртути в разбавленной азотной кислоте образуется нитрат ртути (I),
6Hg + 8HNO3 => 3Hg2(NO3)2 + 2NO + 4H2O
При растворении ртути в горячей концентрированной серной кислоте в зависимости от избытка ртути или кислоты образуются соли одновалентной или двухвалентной ртути:
Hg + 2H2SO4 => HgSO4 + SO2 + 2H2O
2Hg + 2H2SO4 => Hg2SO4 + SO2 + 2H2O
Ртуть растворяется в царской водке:
3Hg + 2HNO3 + 6HCl => 3HgCl2 + 2NO + 4H2O
Оксид ртути (II) HgO; красный кристаллический или желтый аморфный порошок; плохо растворим в воде; раствор имеет слабо щелочную реакцию.
Слайд 153
Получение:
Hg2(NO3)2 → 2HgO + 2NO2↑
2Hg(NO3)2 → 2HgO +

4NO2↑ + O2↑
Hg 2+ + 2OH- → HgO +
H2O
Химические свойства.
Легко восстанавливается; при нагревании разлагается на ртуть и кислород. Реагирует с кислотами с кислотами с образованием солей и воды.
Сульфид ртути (II) HgS (киноварь) – ярко-красный нерастворимый в воде порошок.
Hg + S → HgS
Hg2+ + S2- → HgS
Галогениды ртути (II)
Получение
Hg + Br2 → HgBr2
HgO + 2HCl(сулема) → HgCl2 + H2O
Сулему также получают растворением ртути в царской водке.
Химические свойства:
HgI2 + 2KI → K2[HgI4](реактив Несслера)
Реактив Несслера используется в качестве очень чувствительного аналитического реагента для обнаружения иона NH4+:
2[HgI4]2- + NH4+ + 4OH- → [
]+(коричневый осадок) I-¯ + 7I- + 3H2O
Сульфат ртути (II) и нитрат ртути (II). Получают растворением ртути или оксида ртути (II) в концентрированных серной или азотной кислотах соответственно.
Hg + 2H2SO4(горячая,конц.) → HgSO4 + SO2 + 2H2O
HgO + H2SO4 → HgSO4 + H2O
3Hg + 8HNO3(конц.) → 3Hg(NO3)2 + 2NO ↑+ 4H2O
HgO + 2HNO3 → Hg(NO3)2 + H2O
Более активные металлы легко вытесняют ртуть из ее солей:
Cu + Hg(NO3)2 → Cu(NO3)2 + Hg
Слайд 154
Подгруппа марганца
Побочная подгруппа VII группы
Свойства элементов подгруппы марганца
Физические свойства
Серебристо-белые, тугоплавкие металлы.
Химические свойства
1. В ряду
Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2H+ → Mn2+ + H2↑
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной кислотой:
3Tc + 7HNO3 → 3HTcO4 + 7NO↑ + 2H2O
2. С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Слайд 155
Марганец и его соединения
Марганец
Электронная конфигурация валентного слоя
Получение
Алюмотермия: 3MnO2 + 4Al → 2Al2O3 + 3Mn
Химические
свойства
Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Mn + S → MnS
Растворяется в кислотах:
Mn + 2HCl → MnCl2 + H2
(При этом образуются соединения двухвалентного марганца).

Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2 водородом:
MnO2 + H2 → MnO + H2O
Гидроксид марганца (II) Mn(OH)2 - светло-розовое нерастворимое в воде основание:
MnSO4 + 2NaOH → Mn(OH)2¯ + Na2SO4
Mn2+ + 2OH- → Mn(OH)2
Легко растворимо в кислотах:
Mn(OH)2 + 2HCl → MnCl2 + 2H2O
Mn(OH)2 + 2H+ → Mn2+ + 2H2O
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O2 + 2H2O → 2[MnO2 • 2H2O]
При действии сильных окислителей наблюдается переход Mn2+ в MnO4-:
2Mn(OH)2 + 5Br2 + 12NaOH –кат.CuSO4→ 2NaMnO4 + 10NaBr + 8H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
Оксид марганца (IV) MnO2 - тёмно-коричневый порошок, нерастворимый в воде. Образуется при термическом разложении нитрата марганца (II):
Mn(NO3)2 → MnO2 + 2NO2
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 600°C) или Mn3O4 (при 1000°C).
Сильный окислитель:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
При сплавлении с содой и селитрой образует манганат натрия тёмно - зелёного цвета:
MnO2 + Na2CO3 + NaNO3 → Na2MnO4 + NaNO2 + CO2
Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMn+7O4 + 2KOH → Na2SO4 + 2K2Mn+6O4 + H2O
Гидролиз манганатов протекает по схеме:
3K2MnO4 + 2H2O « 2KMnO4 + MnO2 + 4KOH
MnO42-
MnO2
H+OH бурый
фиолетовый нейтральной осадок
раствор среде неустойчив
переходит
в MnO2
бурый
осадок
3MnO42- + 2H2O « 2MnO4- + MnO2 + 4OH-
За способность обратимо менять окраску манганат калия называют "минеральным хамелеоном".
Оксид марганца (VII) Mn2O7 - тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический
KMnO4 (марганцевая кислота HMnO4 нестабильна):
2KMnO4 + H2SO4 → Mn2O7¯ + K2SO4 + H2O
При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH → 2KMnO4 + H2O
Перманганат калия KMn+7O4 -тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода:
2KMnO4 –t°→ K2MnO4 + MnO2 + O2
Сильный окислитель, причём восстанавливается в кислой среде до Mn2+, в нейтральной – до Mn+4O2, а в щелочной – до Mn+6O42-.
Слайд 158
Щелочноземельные металлы
Свойства щелочноземельных металлов
Физические свойства
Щелочноземельные металлы (по
сравнению со щелочными металлами) обладают более высокими t°пл. и
t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
1. Очень реакционноспособны.
2. Обладают положительной валентностью +2.
3. Реагируют с водой при комнатной температуре (кроме Be) с выделением водорода.
4. Обладают большим сродством к кислороду (восстановители).
5. С водородом образуют солеобразные гидриды ЭH2.
6. Оксиды имеют общую формулу ЭО. Тенденция к образованию пероксидов выражена слабее, чем для щелочных металлов.
Слайд 159
Нахождение в природе
Be
3BeO • Al2O3 • 6SiO2 –
берилл
Mg
MgCO3 – магнезит
CaCO3 • MgCO3 – доломит
KCl • MgSO4
• 3H2O – каинит
KCl • MgCl2 • 6H2O – карналлит
Ca
CaCO3 – кальцит (известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат (флюорит)
Sr
SrSO4 – целестин
SrCO3 – стронцианит
Ba
BaSO4 – барит
BaCO3 – витерит
Получение
Бериллий получают восстановлением фторида:
BeF2 + Mg –t°→ Be + MgF2
Барий получают восстановлением оксида:
3BaO + 2Al –t°→ 3Ba + Al2O3
Остальные металлы получают электролизом расплавов хлоридов:
CaCl2 → Ca + Cl2
катод: Ca2+ + 2ε → Ca0
анод: 2Cl- – 2ε → Cl02
Металлы главной подгруппы II группы - сильные восстановители; в соединениях проявляют только степень окисления +2. Активность металлов и их восстановительная способность увеличивается в ряду:
––Be–Mg–Ca–Sr–Ba→
Слайд 160
1. Реакция с водой.
В обычных условиях поверхность Be

и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы
по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являтся сильными основаниями:
Mg + 2H2O –t°→ Mg(OH)2 + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
2Mg + O2 → 2MgO
Ba + O2 → BaO2
3. С другими неметаллами образуются бинарные соединения:
Be + Cl2 → BeCl2(галогениды)
Ba + S → BaS(сульфиды)
3Mg + N2 → Mg3N2(нитриды)
Ca + H2 → CaH2(гидриды)
Ca + 2C → CaC2(карбиды)
3Ba + 2P → Ba3P2(фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все металлы растворяются в кислотах:
Ca + 2HCl → CaCl2 + H2↑
Mg + H2SO4(разб.) → MgSO4 + H2↑
Бериллий также растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2↑
5. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
Ca2+ - темно-оранжевый
Sr2+- темно-красный
Ba2+ - светло-зеленый
Катион Ba2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
Сульфат бария – белый осадок, нерастворимый в минеральных кислотах.
Оксиды щелочноземельных металлов
Слайд 161
Получение
1) Окисление металлов (кроме Ba, который образует

пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO3 –t°→ CaO +
CO2↑
2Mg(NO3)2 –t°→ 2MgO + 4NO2↑ + O2↑
Химические свойства
Типичные основные оксиды. Реагируют с водой (кроме BeO), кислотными оксидами и кислотами
MgO + H2O → Mg(OH)2
3CaO + P2O5 → Ca3(PO4)2
BeO + 2HNO3 → Be(NO3)2 + H2O
BeO - амфотерный оксид, растворяется в щелочах:
BeO + 2NaOH + H2O → Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов R(OH)2
Получение
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2H2O → Ba(OH)2 + H2↑
CaO(негашеная известь) + H2O → Ca(OH)2(гашеная известь)
Химические свойства
Гидроксиды R(OH)2 - белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера:
Be(OH)2 – амфотерный гидроксид
Mg(OH)2 – слабое основание
остальные гидроксиды - сильные основания (щелочи).
1) Реакции с кислотными оксидами:
Ca(OH)2 + SO2 → CaSO3 + H2O
Ba(OH)2 + CO2 → BaCO3¯ + H2O
2) Реакции с кислотами:
Mg(OH)2 + 2CH3COOH → (CH3COO)2Mg + 2H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
3) Реакции обмена с солями:
Ba(OH)2 + K2SO4 → BaSO4¯+ 2KOH
4) Реакция гидроксида бериллия со щелочами:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Слайд 162
Жесткость воды
Природная вода, содержащая ионы Ca2+ и Mg2+,

называется жесткой. Жесткая вода при кипячении образует накипь, в
ней не развариваются пищевые продукты; моющие средства не дают пены.
Карбонатная (временная) жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная (постоянная) жесткость – хлоридов и сульфатов.
Общая жесткость воды рассматривается как сумма карбонатной и некарбонатной.
Удаление жесткости воды осуществляется путем осаждения из раствора ионов Ca2+ и Mg2+:
1) кипячением:
Сa(HCO3)2 –t°→ CaCO3¯ + CO2↑ + H2O
Mg(HCO3)2 –t°→ MgCO3¯ + CO2↑ + H2O
2) добавлением известкового молока:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3¯ + 2H2O
3) добавлением соды:
Ca(HCO3)2 + Na2CO3 → CaCO3¯+ 2NaHCO3
CaSO4 + Na2CO3 → CaCO3¯ + Na2SO4
MgCl2 + Na2CO3 → MgCO3¯ + 2NaCl
4) пропусканием через ионообменную смолу
а) катионный обмен:
2RH + Ca2+ → R2Ca + 2H+
б) анионный обмен:
2ROH + SO42- → R2SO4 + 2OH-
(где R - сложный органический радикал)
Для удаления временной жесткости используют все четыре способа, а для постоянной - только два последних
Слайд 163
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Общая характеристика
Свойства щелочных металлов
Физические свойства
Низкие температуры плавления,
малые значения плотностей, мягкие, режутся ножом.
Низкий потенциал ионизации, который
уменьшается с увеличением атомного номера.
Химические свойства
Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла.
Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды.
Нахождение в природе
Li
Li2O • Al2O3 • 4SiO2 – сподумен
Na
NaCl – каменная соль
Na2SO4 • 10H2O – глауберова соль (мирабилит)
NaNO3 – чилийская селитра
K
KCl • NaCl – сильвинит
KCl • MgCl2 • 6H2O – карналлит
K2O • Al2O3 • 6SiO2 – полевой шпат (ортоклаз)

Химические свойства
Все щелочные металлы - очень сильные восстановители, в соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
Все соединения щелочных металлов имеют ионный характер.
Практически все соли растворимы в воде.
1. Активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Реакция с кислотами:
2Na + 2HCl → 2NaCl + H2
3. Реакция с кислородом:
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2(пероксид натрия)
K + O2 → KO2(надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
4. В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl(галогениды)
2Na + S → Na2S(сульфиды)
2Na + H2 → 2NaH(гидриды)
6Li + N2 → 2Li3N(нитриды)
2Li + 2C → 2Li2C2(карбиды)
Реагируют со спиртами и галогенопроизводными углеводородов (смотри "Органическую химию")
5. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Оксиды щелочных металлов – R2O
Получение
Окислением металла получается только оксид лития
4Li + O2 → 2Li2O
(в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li2O) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Na2O2 + 2Na → 2Na2O
KO2 + 3K → 2K2O
Слайд 165
Химические свойства
Типичные основные оксиды.
Реагируют с водой, кислотными оксидами

и кислотами:
Li2O + H2O → 2LiOH
Na2O + SO3 →
Na2SO4
K2O + 2HNO3 → 2KNO3 + H2O
Пероксид натрия Na2O2
Получение
2Na + O2 → Na2O2
Химические свойства
1. Сильный окислитель:
2NaI + Na2O2 + 2H2SO4 → I2 + 2Na2SO4 + 2H2O
2Na2O2 + 2CO2 → 2Na2CO3 + O2
2. Разлагается водой:
Na2O2 + 2H2O → 2NaOH + H2O2
Надпероксид калия KO2
Получение
K + O2 → KO2
Химические свойства
1. Сильный окислитель:
4KO2 + 2CO2 → 2K2CO3 + 3O2
2. Разлагается водой:
2KO2 + 2H2O → 2KOH + H2O2 + O2
Гидроксиды щелочных металлов – ROH
Белые, кристаллические вещества, гигроскопичны; хорошо растворимы в воде (с выделением тепла). В водных растворах нацело диссоциированы.
Получение
1. Электролиз растворов хлоридов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
катод: 2H+ + 2e → H02↑
анод: 2Cl- – 2e → Cl02↑
2. Обменные реакции между солью и основанием:
K2CO3 + Ca(OH)2 → CaCO3¯ + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2Li + 2H2O → 2LiOH + H2↑
Li2O + H2O → 2LiOH
Na2O2 + 2H2O → 2NaOH + H2O2
Слайд 166
Химические свойства
R–OH – сильные основания (щелочи) (основность увеличивается
в ряду LiOH – NaOH – KOH – RbOH
–CsOH); реагируют с кислотными оксидами и кислотами:
2NaOH + CO2 → Na2CO3 + H2O
LiOH + HCl → LiCl + H2O
При сплавлении NaOH с ацетатом натрия образуется метан:
NaOH + CH3COONa –t°→ Na2CO3 + CH4↑
Слайд 167
Электрохимические процессы
Электродный потенциал
Одним из центральных понятий в

электрохимии является электродный потенциал, который связан с возникновением двойного
электрического слоя на границе металл раствор.
Рассмотрим механизм возникновения электродного потенциала на примере ионно-металлического электрода, который представляет собой металлическую пластину, погруженную в полярную жидкость.
Как известно, в кристаллической решетке металлов находятся как атомы, так и ионы, связанные подвижным равновесием:
Ме Меn+ + ne-
где Ме – атом металла, Меn+ - ион металла, n – заряд иона, e- - электрон.
Под действием полярных молекул воды ионы поверхностного слоя металла гидратируются и переходят в раствор, заряжая его положительно, а избыток электронов на металле создают отрицательный заряд. Появление отрицательного заряда на электроде препятствует выходу катионов в раствор, часть же катионов из раствора, взаимодействуя с электронами, входят в узлы кристаллической решетки металла, которую они покинули. При достижении равенства скоростей выхода катионов в раствор и их вхождением в металл устанавливается динамическое равновесие.
Ме + aq Меn+ · aq + ne- (1)
где aq – молекулы воды.
Результатом установившегося динамического равновесия является возникновение двойного электрического слоя (рис. 1), который напоминает плоский конденсатор, одна из обкладок которого представлена поверхностью металла, а другая – слоем ионов, находящихся в растворе.

раствор
Рис. 1 Двойной электрический слой на границе раздела фаз
металл – раствор
Однако ионный слой не весь сосредоточен у поверхности металла, а вследствие теплого движения частично размыт в растворе. На границе раздела фаз металл – раствор (как и в случае между обкладками конденсатора) возникает разность электростатических потенциалов, которую называют скачком потенциала или электродным потенциалом.
Аналогичный процесс можно наблюдать и при погружении металла в водный раствор собственной соли. Здесь могут наблюдаться три случая:
1.Вследствие увеличения концентрации катионов в растворе равновесие (1) будет смещено в сторону входа катионов в узлы кристаллической решетки, поэтому отрицательный заряд электрода в растворе собственной соли будет меньше, чем в чистой воде.
2.Изменяя концентрацию соли в растворе, можно добиться того, что образование двойного электрического слоя не произойдет.
3.Малоактивные металлы: медь, серебро, золото, платина и другие характеризуются наличием прочной металлической решетки (высокой энергией связи катиона с электроном). В данном случае окисление металла происходит с трудом, в то время как катионы из раствора активно осаждаются на поверхность металла. Электрод в этом случае заряжается положительно, а раствор отрицательно, из-за избытка оставшихся в нем анионов.
Таким образом, строение двойного электрического слоя, а следовательно, и электродный потенциал зависят от металла, который используют в качестве электрода, концентрации катионов металла в растворе, оказывающей влияние на равновесие (1), и температуры, которая влияет на Кр.
Зависимость электродного потенциала от концентрации катионов в растворе и температуры описывается уравнением:
(2)
где n – число е- участвующих в окислительно-восстановительной реакции, F – число Фарадея, R – универсальная газовая постоянная, a(ax), а(red) – активности, соответственно, окисленной и восстановительной формы. Если рассматривать потенциал металла в растворе его собственной соли, то при Р = 101,3 кПа и Т = 298 К активность чистого металла постоянна и принята равной единице, следовательно а(red) = a(Me) = 1. В этом случае выражение (2) упрощается:
Слайд 169
(3)
В разбавленном растворе вместо активностей можно подставить концентрации.
Уравнение (2) носит название уравнения Нернста, которое характеризует электродный
потенциал в условиях отличных от стандартных. В данном уравнении φ0 – стандартный электродный потенциал. Стандартным электродным потенциалом считают потенциал, возникающий при погружении металлического электрода в раствор собственной соли при стандартных условиях (Т= 298, концентрация катионов металла – 1 моль · л-1) и измеренный относительно водородного электрода. Если в уравнении (2) подставить значения соответствующих констант R, T и F, то с учетом перехода от ln к lg получим:

Окислительно-восстановительные потенциалы
Окислительно-восстановительным называют потенциал, возникающий на границе
платинового электрода и раствора, содержащего окисленную и восстановленную форму вещества. Для примера рассмотрим платиновую пластину, погруженную в водный раствор солей FeCl2 и FeCl3.
Платина является инертным металлом и поэтому переход катионов платины в раствор невозможен.
Катионы Fe3+ являются окисленной формой по отношению к катионам Fe2+ и могут восстанавливаться, отбирая при этом электроны у платинового электрода и заряжая его положительно. Катионы Fe2+ являются восстановленной формой и отдают электроны платине, окисляясь до Fe3+. При достижении равенства скоростей процессов окисления и восстановления устанавливается химическое равновесие.
Суммарный окислительно-восстановительный потенциал зависит от концентрации как окисленной (Fe3+) так и восстановительной (Fe2+) формы катионов железа в растворе и определяются уравнением Нерства:
Стандартным окислительно-восстановительным потенциалом φ0oх/red считают потенциал, возникающий на платиновом электроде, погруженном в раствор с концентрацией окисленной и восстановительной формы, равной 1 моль/л при температуре 298 К.
Измеряют величины стандартных окислительно-восстановительных потенциалов относительно стандартного водородного электрода. Некоторые значения φ0oх/red приведены в таблице 2.
Слайд 171
Измерение электродного потенциала
Измерить абсолютное значение электродного потенциала, возникающего

на границе металл – раствор, невозможно, так как для
подключения измерительного прибора необходим второй металлический электрод. В таком случае измеряют только относительную величину потенциала по отношению к электроду, принятому за стандарт. Согласно международному соглашению таким стандартным электродом является водородный электрод, потенциал которого принят равным нулю.
Водородный электрод состоит из платиновой пластины, покрытой тонким слоем платиной черни и опущенной в водный раствор серной кислоты с активной концентрацией а(Н+), равной 1 моль · л-1. Через этот раствор пропускается ток чистого водорода под давлением 101,3 кПа, который омывает платиновую пластину. Избыток водорода удаляется через верхнюю трубку (рис. 2). Платина, как и многие другие металлы этой группы, способна насыщаться водородом, в результате чего вся поверхность платиновой пластинки оказывается покрытой слоем водорода. В результате адсорбции на платине в газовой форме уста вливается равновесие
Н2 2Н+
Таким образом, водородный электрод, подобно металлическому, представляет собой восстановительную форму Н0, погруженную в раствор, содержащий окисленную форму Н+.
Рис. 2. Строение водородного электрода
Слайд 172
Между поверхностным слоем водорода на платине и раствором

устанавливается равновесие
Н+ + е- Н
и возникает
разность потенциалов, которая, как указано выше, принята равной нулю.
Для измерения величины стандартного электродного потенциала металлического электрода, данный электрод соединяют с водородным электродом проводником первого рода. При замыкании электрической цепи вследствие разности электродных потенциалов начнется движение электронов от электрода с меньшим потенциалом (обладающие избытком электронов) к электроду с большим потенциалом (обладающим меньшим количеством электронов). Так, если в качестве измеряемого электрода выступает цинк, то движение электронов будет направлено от цинка к платине. Уменьшение электронов на цинковой пластине будет смещать равновесие в сторону выхода катионов цинка в раствор, а следовательно на цинковом электроде будет протекать процесс окисления.
Zn0 → Zn2+ + 2e
На водородном электроде катионы Н+ принимают электроны и восстанавливаются.
2Н+ + 2е → Н2
Принято считать электрод, на котором протекает процесс окисления – анодом, а на котором процесс восстановления – катодом.
Зная величину ЭДС, измеренную в такой системе, можно легко вычислить потенциал электрода (метод измерения ЭДС разобран в разделе 3).
Так как в рассматриваемом процессе катодом является водородный электрод, а
= 0
- φА = ЭДС
Если потенциал измеряемого электрода больше водородного, то движение электронов будет направлено от платины к металлу и величина потенциала электрода будет положительной.
Слайд 173
Электрохимический ряд напряжений металлов
Если расположить все металлы по

возрастанию величины стандартного электродного потенциала, получают ряд напряжений металлов,
который представляет собой электрохимическую характеристику металлов. В этом ряду, чем ниже алгебраическая величина электродного потенциала, тем с большей легкостью данный металл отдает электроны (окисляется) и тем самым проявляет более высокую восстановительную способность. Например, Ca(
=-2,8 В) является лучшим восстановителем, чем железо
(
- 0,44 В).
Чем больше алгебраическая величина электродного потенциала, тем тяжелее данный металл отдает электроны, а катион, соответствующий данному металлу, является более активным акцептором электронов. Например, катион Cu2+ более сильный окислитель, чем Zn2+, а тем более Cu2+. Таким образом, в электрохимическом ряду напряжений с возрастанием величины стандартного электродного потенциала металлов увеличивается окислительная способность катионов, соответствующих этим металлам, восстановительная же способность атомов металлов в этом ряду уменьшается. С уменьшением стандартного электродного потенциала наблюдается зависимость, противоположная, рассмотренной выше.
Слайд 174
Таблица 1
Электрохимический ряд напряжений металлов
Слайд 175
Все металлы, расположенные в электрохимическом ряду напряжений до

водорода, имеют более отрицательный потенциал, чем у водорода, а
следовательно, в стандартных условиях могут быть окислены Н+. По этой причине эти металлы могут вытеснять водород из растворов разбавленных сильных минеральных кислот. Металлы, расположенные после водорода, не вытесняют водород из растворов разбавленных кислот.
Потенциал водородного электрода зависит от концентрации катионов Н+ в растворе
= 0,059lg[H+]
Так как величина lg[H+] = -рН
= - 0,059рН
Из этого следует, что металлы, имеющие более отрицательный потенциал, чем –0,413 В, могут восстанавливать водород из воды. К ним относятся металлы, включая кадмий. Однако на практике не все металлы, расположенные до кадмия, вытесняют водород из воды, а металлы, расположенные до водорода – водород из растворов кислот. Это происходит потому, что при окислении некоторых металлов на их поверхности образуются нерастворимые пленки, препятствующие дальнейшему взаимодействию. Примером этому может служить пассивирование свинца в серной кислоте из-за нерастворимости соли PbSO4. Металлы в ряду электрохимического напряжения до магния взаимодействуют с водой, магний вытесняет водород из горячей воды, а все последующие металлы, включая кадмий, образуют на поверхности нерастворимые гидроксиды и не взаимодействуют с водой.
Таким образом, электрохимический ряд напряжений металлов нужно использовать с учетом особенностей данного химического процесса.
Слайд 176
Таблица 2
Cтандартных окислительно-восстановительных
потенциалов
Слайд 177
Направление окислительно-восстановительных реакций
Рассмотрим реакцию хлорида железа (III) с

хлоридом олова (II), которая протекает по схеме:
2FeCl3 + SnCl2
= 2FeCl2 + SnCl4 (5)
Для предсказания возможности протекания данной реакции необходимо рассчитать величину изобарно-изотермического потенциала ΔG. Реакция протекает в сторону уменьшения свободной энергии Гиббса (ΔG < 0). Однако для окислительно-восстановительных реакций критерием направленности процесса могут служить величины окислительно-восстановительных потенциалов.
Представим реакцию (5) в виде:
Fe3+ + e = Fe2+
Sn2+ + 2e = Sn4+
Каждая из этих реакций характеризуется своим потенциалом
(
= 0,771 В.
= 0,153 В).
Так как перемещение электрона возможно от электрода с меньшим потенциалом к электроду с большим потенциалом, так и окислительно-восстановительная реакция протекает от меньшего значения окислительно-восстановительного потенциала к большему. На электроде с меньшим значением φ идет процесс окисления, а на электроде с большим значением φ – восстановления. Следовательно, в стандартных условиях катионы Fe3+ могут окислить катионы Sn2+ , так как значение
<
С увеличением концентрации катионов Sn4+ величина окислительно-восстановительного потенциала
увеличивается, а с увеличением концентрации Fe2+ величина
уменьшается.
Окислительно-восстановительная реакция возможна до установления в системе равенства потенциалов. Таким образом, разность Δφ (т.е. ЭДС) при стандартных условиях может служить критерием возможности протекания процесса. Окислительно-восстановительная реакция протекает в направлении от меньшего окислительно-восстановительного потенциала к большему до состояния равновесия. В этом же направлении изменяется (уменьшается) свободная энергия Гиббса, которая связана с изменением потенциала уравнением
ΔG = -nFΔφ
где n - число электронов,
F – число Фарадея.
Слайд 178
Гальванический элемент
Гальванический элемент – это устройство, в котором
химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток.
Гальванический элемент состоит из двух электродов, соединенных металлическим проводником. Работа гальванических элементов основана на пространственном разделении процессов окисления и восстановления.
Например, если из окислительно-восстановительных систем Zn2+/Zn и Cu2+/Cu составить электрохимическую цепь (цинковую и медную пластинки поместить соответственно в растворы ZnSO4 и CuSO4, разделенные диафрагмой), то получим гальванический элемент Даниэля-Якоби (рис. 3).
Рис. 3. Схема гальванического элемента Даниэля-Якоби
Слайд 179
На границе раздела фаз металл – раствор возникает

двойной электрический слой и устанавливаются равновесные электродные потенциалы, характеризующие
равновесие для цинкового электрода
Zn Zn2+ + 2e и для медного электрода Cu Cu2+ + 2e.
Для внешней цепи этой электрохимической системы цинковый электрод станет отрицательным полюсом
(
), а медный – положительным (
0,34 В).
Если замкнуть внешнюю цепь, то вследствие разности потенциалов цинка и меди, часть электронов с цинковой пластины перейдет на медную. Это нарушит равновесие в двойном слое у цинка (его потенциал повысится) и у меди (ее потенциал понизится). Изменение потенциала связано с изменением концентрации катионов металла у электродов. Обе системы Zn2+/Zn и Сu2+/Cu снова стремятся к равновесию за счет окисления цинка (Zn → Zn2++ 2e) и восстановление меди (Сu2++2е-→ Сu). Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая электрический ток в цепи. Во внутреннем участке цепи анионы SO42- перемещаются от медного электрода, где их избыток к цинковому, а катионы Zn2+ и Сu2+ - в обратном направлении, обеспечивая протекание ионного тока в растворе. Суммарный процесс выражается тем же уравнением реакции, что и при непосредственном взаимодействии окислительно-восстановительных систем
Zn2+/Zn и Сu2+/Cu.
Zn + Сu2+ → Cu + Zn2+
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительный и восстановительный процессы оказываются разделенными пространственно: на положительном электроде (катоде) происходит процесс восстановления, а на отрицательном (аноде) – процесс окисления.
Слайд 180
Необходимое условие работы гальванического элемента – разность потенциалов

электродов. Наибольшего значения работа гальванического элемента достигает при изотермическом
обратимом проведении реакции. В этом случае разность потенциалов максимальна и называется электродвижущей силой гальванического элемента (ЭДС). При схематической записи гальванического элемента границу раздела между металлом и раствором обозначают одной вертикальной чертой, а границу раздела между растворами – двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде:
Zn0/ Zn2+ // Cu2/ Cu0
ЭДС элемента (Е) равна разности электродных потенциалов Cu и Zn. Так как ЭДС величина положительная, то для ее расчета от потенциала катода вычитают потенциал анода (Е = ϕCu2+/Cu - ϕZn2+/Zn = 1,1 В).
Измерить ЭДС элемента можно скомпенсировав ее от внешнего источника (противоположно направленной ЭДС) – компенсационным методом (рис. 4). Перемещая подвижный контакт К, можно подобрать такое положение на потенциометре, при котором ток в цепи будет отсутствовать и в системе у электродов достигается равновесие, т.е. создаются условия, необходимые для протекания обратимых полуреакций и электрическая работа элемента будет максимальна. Следовательно, падение напряжения на участке АК и есть ЭДС гальванического элемента.
Рис. 4. Схема компенсационного измерения ЭДС
Е1 – внешний источник
Е2 – гальванический элемент, АВ – потенциометр
К – подвижный контакт, Г – гальванометр.
Более простой и менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое входное сопротивление.
В рассмотренном элементе Даниэля-Якоби материал электрода сам участвует в окислительно-восстановительных реакциях. Такие элементы называются элементами с активным электродом. В окислительно-восстановительных гальванических элементах с инертными электродами металл электрода служит лишь передатчиком электронов. Например,
Pt Sn2+, Sn4+ Fe3+, Fe2+ Pt
Один полуэлемент (электрод) представляет собой раствор, состоящий из смеси солей Sn2+ и Sn4+, в который погружен платиновый электрод. На поверхности электрода устанавливается равновесие
Sn2+ Sn4++ 2е, которое определяет потенциал электрода (в стандартных условиях)
= 0,15 В). В другом полуэлементе платиновый электрод погружается в раствор смеси солей Fe3+ и Fe2+ (например, FeCl3 и FeCl2). На его поверхности устанавливается равновесие Fe2+ Fe3+ + е, характеризуемое в стандартных условиях потенциалом
= 0,77 В. Следовательно, при замыкании внешней цепи, состоящей из этих двух полуэлементов, один из них будет выступать анодом (Pt/Sn4+, Sn2+), а второй – катодом (Fe3+, Fe2+/Pt) и Е = 0,77 В – 0,15 = 0,62 В.
Слайд 181
Необходимую для работы гальванического элемента разность потенциалов можно
создать, используя одинаковые электроды и один и тот же
раствор, но разной концентрации разной концентрации. В этом случае гальванический элемент называется концентрационным и работает он за счет выравнивания концентраций растворов.
Zn0 / Zn2+ // Zn2+/ Zn
а| = 0,1моль/л а|| = 0,001моль/л
Е = ϕК - ϕА =
Слайд 182
Поляризация и перенапряжение
ЭДС работающего элемента всегда меньше той

расчетной величины, которая отвечает обратимой электрохимической
реакции. Причиной этого является
поляризация. Поляризацией называется явление изменения потенциала от своего равновесного значения при протекании тока.Если в отсутствии тока система находится в равновесии, то мерой поляризации служит перенапряжение: η = ϕP - ϕ(i) где ϕP – равновесный потенциал, ϕ(i) – потенциал при протекание тока.
Возникновение поляризации обусловлено замедленностью отдельных стадий электрохимического процесса, который включает в себя по крайней мере три стадии:
1. подвод реагентов к электроду;
2. собственно электрохимическая реакция;
а) стадия разряда (окисления-восстановления), например, Н+ + е → Н;
б) химическая реакция, сопровождающая стадию разряда 2Н → Н2.
3. отвод продуктов реакции.
Соответственно, в зависимости от характера самой медленной стадии различают три вида поляризации:
3.1 Концентрационная поляризация – изменение потенциала электрода по сравнению с исходным равновесным значением, вызванное изменением концентрации потенциалопределяющих ионов. Этот вид поляризации наблюдается при работе элемента Даниэля-Якоби. При окислении цинкового электрода в приэлектродном слое накапливаются катионы цинка Zn2+ и согласно уравнению Нернста, потенциал этого электрода увеличивается. И, наоборот, у медного электрода концентрация ионов Cu2+ уменьшается вследствие их восстановления, и потенциал медного электрода уменьшается.
3.2. Химическая поляризация связана с изменением химической природы электрода. Так в элементе Вольта Zn H2SO4 Cu поверхность медного электрода (катода) насыщается водородом (2Н+ + 2е → Н2) и образуется «водородный» электрод, потенциал которого имеет более низкое значение, чем потенциал медного электрода.
Изменение потенциала, обусловленное замедленностью электрохимических стадий реакций – называется электрохимической поляризацией и характеризуется перенапряжением перехода. Эта стадия играет главную роль в электрохимической кинетике, т.к. на перенос заряда непосредственно влияет потенциал электрода. Связь между перенапряжением перехода и плотностью тока выражается уравнением Тафеня: η = а + в lgi
Константа «в» зависит от природы окислителя и восстановителя, температуры, «а» – от природы окислителя и восстановителя, состава раствора, температуры, материала электрода, «i» - плотность тока.
При использовании гальванического элемента, как источника питания, важное значение приобретает процесс устранения поляризации – так называемая деполяризация. Так, например, перемешивание раствора способствует уменьшению концентрационной поляризации. Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от плотности тока, протекающего в системе, так называемую поляризационную кривую. Согласно первому закону Фарадея, ток, протекающий в системе, пропорционален количеству вещества, прореагировавшего на электроде в единицу времени, т.е. скорости электрохимической реакции. Так как в зависимости от площади электрода при одном и том же потенциале токи могут быть разными, то скорость реакции относят к единице площади поверхности электрода и характеризуют плотность тока
i =
Слайд 183
На рисунке 5 представлены поляризационные кривые элемента Даниэля-Якоби.
Рис.
5. Поляризационные кривые, характеризующие работу гальванического элемента
Е – ЭДС
гальванического элемента
U – напряжение, снимаемое с клемм
ηа и ηк - анодное и катодное перенапряжение, соответственно.
Скорость электрохимической реакции, протекающей на аноде, характеризуют плотностью анодного тока (ia), на катоде – плотностью катодного тока (iк). Перенапряжение обусловлено конечной скоростью электродной реакции и количественно характеризует замедленность протекания отдельных ее стадий.
Напряжение «U» , измеряемое на электродах при протекании в системе плотности тока i, меньше, чем ЭДС. Чем больше ток в системе, тем сильнее отклонение потенциала от равновесного, т.е. тем выше поляризация и меньше U.
Слайд 184
Электролиз
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при

прохождении постоянного тока через раствор или расплав электролита.
При электролизе
происходит превращение электрической энергии в химическую. Процессы окисления и восстановления и в этом случае пространственно разделены: они протекают на разных электродах. На отрицательном электроде (катоде) происходит восстановление катионов, а на положительном электроде (аноде) – окисление анионов. Характер протекания электродных процессов при электролизе зависит от многих факторов: состава электролитов, материала электрода, режима электролиза (i, Т).
Различают электролиз расплавов и растворов электролитов.
В качестве примера рассмотрим электролиз расплава бромида натрия. В расплаве соли бромида натрия NaBr существуют ионы Na+ и Br-. При подведении напряжения к электродам через расплав начнет протекать электрический ток.
Катионы Na+ подходят к катоду и восстанавливаются до металлического натрия, за счет электронов, поступающих к электроду от внешнего источника Na+ + е = Na. К аноду подходят бромид-ионы Br- и окисляются до Br2, отдавая электроны во внешнюю цепь 2Br- - 2е = Br2.
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных реакций и для бромида натрия она выразится уравнением:
2Na+ + 2Br- электролиз 2Na + Br2
Электролиз водных растворов электролитов осложняется участием в электродных реакциях молекул воды, способных восстанавливаться на катоде (2Н2О + 2е = Н2 + 2ОН-,
= -0,41 В) и окисляться на аноде
(2Н2О - 4е = О2 + 4Н+,
= 0,814 В).
Слайд 185
На электродах возможно и разрядка ионов Н+ и

ОН-, относительная концентрация которых определяется средой.
Из нескольких возможных параллельных
электродных процессов будет протекать тот, осуществление которого требует меньшей затраты энергии. Критериями, определяющими преимущества того или иного электрохимического процесса, служат величины электродных потенциалов соответствующих равновесных систем.
В общем случае на аноде легче окисляются атомы, молекулы или ионы с наименьшим электродным потенциалом, а на катоде восстанавливаются те ионы, молекулы, атомы, потенциалы которых наиболее высокие.
Например, при электролизе нейтрального водного раствора NaI на катоде будут восстанавливаться молекулы воды, так как
= -0,41 В, а
= -2,71В. Окисляются же на аноде ионы I-, так как
= 0,536 В, а
= 0,814 В. Схематически это можно записать следующим образом:
NaI
на катоде (-) : в растворе : (+) на аноде
← Na+ + I- →
← H2O →
2 Н2О + 2е- = Н2↑ + 2ОН- 2I- - 2е = → J2
2NaI + 2 Н2О электролиз Н2↑ + I2 + 2NaОН
Для качественного предсказания результатов электролиза водных растворов электролитов можно руководствоваться следующими практическими правилами:
Для процессов на катоде:
1. В
первую очередь восстанавливаются катионы металлов, имеющие электродный потенциал положительнее водородного (от Cu2+ до Au3+);
2. катионы металлов, электродные потенциалы которых отрицательнее потенциала алюминия включительно, не восстанавливаются, на катоде идет восстановление молекул воды или ионов Н+;
3. при электролизе солей металлов, электродные потенциалы которых находятся между потенциалами алюминия и водорода, на катоде выделяются совместно как металлы, так и водород.
Если электролит содержит катионы различных металлов, то при электролизе восстановление их на катоде протекает в порядке уменьшения стандартного электродного потенциала соответствующего металла. Так из смеси Sn2+, Cu2+, Cr3+сначала будут восстанавливаться катионы меди,
= 0,34 В, затем катионы олова
= -0,136 В и, наконец, катионы хрома
= -0,744 В.

Для процессов
на аноде:
характер окислительных процессов зависит от материала электрода. Различаются нерастворимые (инертные) электроды и растворимые (активные) электроды. Инертные электроды изготовляются обычно из платины, графита, иридия. В процессе электролиза они служат лишь для передачи электронов во внешнюю цепь. При использовании инертных электродов:
1. в первую очередь окисляются анионы бескислородных кислот в порядке возрастания их φ (S-2, I-, Вr-, Cl-);
2. при электролизе водных растворов, содержащих анионы кислородосодержащих кислот (CO32-, NO3-, SO42-, PO43-), на аноде окисляются молекулы воды.
3. в щелочных растворах окисляются гидроксид-ионы:
4OH- - 4e → O2 ↑ + 2H2O
При использовании растворимых анодов (из меди, цинка, никеля, серебра и т.д.) анодному окислению будет подвергаться сам материал анода:
Ме0 → Men+ + ne-
анод уходят уходят
раствор во внешнюю цепь
Так, например, при электролизе раствора сульфата меди с медным анодом происходит его растворение, поскольку потенциал системы:
Cu Cu2+ + 2e- (0,34 В)
меньше потенциалов других возможных анодных процессов:
2SO42- - 2e S2O82- (2,01 В)
и
2Н2О – 4е О2 + 4Н+ (1,23 В при рН < 7).
Как будет показано ниже, указанные правила не являются догмой, а руководством к действию и зачастую процессы на аноде и катоде осложняются, так как на практике электрохимические процессы проводят в условиях отличных от стандартных.
Рассмотрим несколько примеров электролиза водных растворов:
Как протекает электролиз раствора сульфата натрия с инертными электродами.
Схематически процесс можно представить так:
Катод (Pt)
р-р Na2SO4 Анод (Pt)
В растворе
← 2Na+ + SO42- →
← Н2О →
4Н2О + 4е- = 2Н2↑ + 4ОН- 2Н2О - 4е- = О2 + 4Н+
Слайд 188
Из вышеприведенной схемы видно, что если катодное и

анодное пространство будут разделены перегородкой, то в прикатодном пространстве
будут накапливаться катионы Na+ гидроксид- анионы, образующиеся в результате восстановления воды. При упаривании воды из этого раствора может быть выделен NaOH. Около анода среда становится кислой, вследствие окисления воды, в результате чего в этой области накапливается серная кислота.
Если катодное и анодное пространства не разделены перегородкой, то ионы Н+ и ОН- образуют воду.
4Н+ + 4ОН- = 4Н2О
Электролиз водного раствора Na2SО4 в конечном итоге сводится к электролизу воды, которая окисляется на аноде и восстанавливается на катоде.
2Н2О 2Н2↑ + О↑2
Как протекает электролиз водного раствора сульфата меди с применением электродов из меди.
Схематически процесс изобразится следующим образом:
Катод (Cu) р-р CuSO4 Анод (Cu)
← Cu2+ + SO42- →
← Н2О →
Cu2+ + 2е = Cu Cu - 2е = Cu2+
Медный анод растворяется, ионы меди Cu2+ перемещаются к катоду и там восстанавливаются до свободного металла. При равных площадях электродов количество соли в растворе остается неизменным: сколько меди растворяется на аноде, столько же ее восстанавливается на катоде.
Слайд 189
Напряжение разложения электролита. Поляризация

электродов
Протекание электрического тока через электрическую ванну приводит к сдвигу
потенциалов от их равновесных значений, отвечающему определенной плотности тока, т.е. к поляризации электродов.
Рассмотрим электролиз 0,1М раствора HCl. Если к электродам приложить небольшую разность потенциалов от внешнего источника тока, а затем постепенно ее увеличивать, то можно зафиксировать изменение силы тока в цепи в зависимости от приложенного напряжения (рис. 6). Лишь при
определенном напряжении (1,3 В) происходит резкое увеличение тока в цепи и одновременно начинается видимое разложение электролита.
Рис. 6. Зависимость силы тока от напряжения при электролизе
При электролизе водного раствора серной кислоты это напряжение –1,7 В, а для раствора сульфата натрия –2,3 В. То есть каждому электролиту свойственно определенное минимальное напряжение, которое необходимо приложить к раствору, чтобы начался электролиз. Такое необходимое напряжение получило название «напряжение разложения» (Uразл.).
Это объясняется тем, что катодный и анодный процессы
2Н+ + 2е = Н2 (на катоде)
2Cl- - 2е = Cl2 (на аноде)
для раствора НCl сопровождаются химической поляризацией электродов, обусловленной превращением катода в водородный электрод а анода в хлорный с соответствующими потенциалами (рис. 7).
Слайд 190
Епол =
Рис. 7. Поляризационные кривые, иллюстрирующие процессы
при электролизе раствора HCl с платиновым электродом
Слайд 191
В результате химической поляризации электродов возникает гальванический элемент,

электродвижущая сила которого равна
Епол =
-
= 1,36 – 0,000 = 1,36 В
и имеет направление противоположное внешней ЭДС. Возникновение обратной ЭДС при электролизе, называемой ЭДС поляризации, составляет сущность явления поляризации при электролизе. Поэтому электролиз возможен при условии компенсации ЭДС поляризации внешним напряжением. Часто реально напряжение разложения оказывается много больше ЭДС поляризации, так как необходимо скомпенсировать еще и водородное перенапряжение на катоде и хлорное перенапряжение на аноде, вызванные замедленностью реакции разряда.
Таким образом, в общем случае напряжение, при котором будет происходить электролиз (напряжение разложения), складывается из ЭДС поляризации (Епол = φk – φА), анодного и катодного перенапряжения (ηA и ηk), омического падения напряжения на электролите (ΔUэл).
Uразл = Епол + ηа + ηк + ΔUэл
Перенапряжение для катодных реакций, в процессе которых выделяются металлы, обычно невелико. Так, для меди и цинка ηk достигает несколько десятков милливольт. Ртуть, серебро, олово, свинец выделяются из водных растворов солей почти без перенапряжения. Наибольшее перенапряжение достигается у металлов семейства железа, доходя до нескольких десятых долей вольта. Очень велико перенапряжение при выделении водорода (водородное перенапряжение). Оно очень сильно зависит от природы катода и состояния его поверхности. Эта зависимость отражена в константе «а» уравнения Тафеля
(η = а + blgi). Постоянная «b» при 20˚С для всех металлов ≈ 0,12 В. В кислых растворах при i = I A/см2 величина «а» для разных металлов имеет следующие значения: платина – 0,1 В; железо – 0,7 В; медь – 0,87 В; олово – 1,2 В; цинк – 1,24 В; свинец –1,56 В; ртуть – 1,47 В. Это делает возможным при электролизе водных растворов разряд ионов тех металлов (Ni, Cd, Cr, Zn и др., вплоть до Mn), потенциалы которых оказываются в соответствующих условиях более электроотрицательными, чем потенциал водородного электрода (рис. 8). Благодаря этому получили широкое распространение методы электроосаждения металлов: например, электролитическое хромирование, цинкование, никелирование, лужение. На ртутном катоде из нейтральных водных растворов удается восстановить даже натрий.
Протекание анодных реакций часто сопровождается выделением газов и для них характерно также высокое перенапряжение, особенно для кислорода ηО2 = 1,5 В. Из-за большого кислородного перенапряжения в случае электролиза раствора NaBr или HCl на платиновом аноде выделяются Br2(
= 1,06 В) и Cl2 (
= 1,36 В),
а не кислород, хотя в нейтральной и кислой средах соответственно равновесный потенциал кислородного электрода ниже, чем у брома и хлора (0,81 В и 1,23 В).
Слайд 192
2Н2O - 4е → O2 = 4H+
Рис. 8.
Полризационные кривые, иллюстрирующие процессы при электролизе
водного раствора хлорида
цинка с графитовыми электродами
Водородное и кислородное перенапряжение имеет большое прикладное значение и должно учитываться при электролизе водных растворов. Их роль в процессах очень различна. Она негативна, например, при промышленном получении кислорода и водорода электролитическим способом, так как перенапряжение связано с дополнительным расходом электроэнергии в этом случае и, позитивна при электролитическом получении металлических покрытий, при зарядке кислотных аккумуляторов и т.д.
Слайд 193
Количественная характеристика электролиза выражается двумя законами Фарадея:
1. Масса

вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через
электролит электричества m = КэQ = КэI · t , где m – масса выделившегося вещества, Q – количество электричества (Кл),
I – сила тока (А), t – время (с), Кэ – электрохимический эквивалент вещества, выделившегося на электродах при протекании тока силой в 1 А в течение 1 сек (или количеством электричества в 1 Кл).
2.При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их эквивалентов.
Кэ =
m =
, где
F – число Фарадея,
Мэ – молярная масса эквивалента.
Если I · t = F = 96500 Кл, то m = Мэ . Для химического превращения молярной массы эквивалента любого вещества необходимо пропустить через электролит количество электричества, равное числу Фарадея (96500 Кл).
На законах Фарадея основан один из точных способов измерения количества электричества, прошедшего в системе. Для этого служат приборы, называемые кулонометрами.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы реально выделенного вещества на электроде к теоретической и умноженное на 100% называют выходом по току:
ηэ =

Химические
источники тока
Любой гальванически элемент может быть источником постоянного тока. Но лишь немногие из них удовлетворяют техническим требованиям, делающим возможным их использование.
В основе некоторых современных сухих батарей, питающих слуховые аппараты, карманные фонари, переносную аппаратуру связи, лежит схема элемента Лекланше, предложенная в 1876 г.:
(-) Zn / NH4Cl / MnO2.(-)
Удобство такого портативного источника тока заключается в том, все его составные части представляют собой твердые или пастообразные вещества, упаковка которых предотвращает их попадание на окружающие предметы. Анодом сухого элемента служит его цинковая оболочка, а катодом – графитовый стержень, спрессованный в слой оксида марганца (IV) и углерода. В качестве электролита используется паста из хлорида цинка, хлорида амония и воды. На электродах сухого элемента протекают следующие полуреакции.
На аноде: Zn(тв) → Znag2+ + 2e-
На катоде: 2MnO2(тв) + 2NH4+ + 2e- → Mn2O3(тв) + 2NH3 + H2O
Суммарная реакция описывается уравнением:
Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)2]Cl2 + Mn2O3 + H2O
Напряжение такого элемента – 1,5 В. Сухие элементы представляют собой первичные химические источники тока (или гальванический элемент одноразового действия). После разрядки сухой элемент использовать нельзя и его приходится выбрасывать.
Вторичным источником тока являются аккумуляторы. Работоспособность разряженного аккумулятора можно восстановить, зарядив его, т.е. пропустив через него в обратном направлении ток от внешнего источника (электролиз). При зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент. Процессы заряда аккумуляторов осуществляются многократно. В таблице 3 приведены характеристики наиболее распространенных гальванических элементов.
Наиболее распространенным является свинцовый (кислотный) аккумулятор. Свинцовый аккумулятор представляет собой систему свинцовых перфорированных пластин, заполненных губчатым свинцом и являющихся катодом, а положительным электродом служит оксид свинца PbO2, впрессованный в свинцовую решетку.
Слайд 195
В качестве электролита используется 30%-ный раствор серной кислоты.

Схема аккумулятора:
Pb ׀ H2SO4 ׀ PbO2
При погружении пластины в серную кислоту на их поверхности образуется труднорастворимая соль-сульфат свинца PbSO4. В этом состоянии электроды имеют одинаковый химический состав и окислительно-восстановительное взаимодействие невозможно, аккумулятор разряжен. Поэтому предварительно проводят зарядку аккумулятора, пропуская через него постоянный электрический ток от внешнего источника. Процессы, протекающие при зарядке подобны процессам при электролизе.
На катоде (-) происходит процесс восстановления.
Pb2+ + 2e- = Pb0
= -0,36 В
Этой реакции разряда соответствует электрохимическая реакция:
PbSO4 + 2H+ + 2e → Pb0 + H2SO4
На аноде (+) ионы Pb2+ окисляются.
Pb2+ - 2е → Pb+4
PbSO4 – 2е + SO42- → Pb(SO4)2
Образующаяся соль подвергается гидролизу
Pb(SO4)2 + 4H2О → Pb(ОН)4 + H2SO4
с последующим разложением
Pb(ОН)4 = PbО2 + 2H2О,
т.е. конечным результатом является образование оксида свинца (IV) - PbО2.
Таким образом, после зарядки один электрод аккумулятора представляет собой губчатый металлический свинец, а другой – оксид свинца (IV).
Общее химическое уравнение процесса зарядки:
PbSO4 + 2H2О → Pb + PbO2 + 2H2SO4
При работе аккумулятора (разрядке) процессы на электродах протекают в обратном направлении.
Окисление на аноде:
Pb – 2е + SO42-→ PbSO4
Восстановление на катоде:
PbO2 + 4Н+ + SO42- + 2е → PbSO4 + 2H2О
Суммарная реакция
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2О
В процессе зарядки концентрация кислоты увеличивается, а в процессе разрядки наоборот, уменьшается. Относительная плотность серной кислоты указывает насколько разряжен аккумулятор. ЭДС свинцового аккумулятора достигает 2,1 В. Напряжение при заряде выше ЭДС и растет в течение заряда. В конце напряжение достигает значения, достаточного для электролиза воды, тогда начинается выделение водорода и кислорода, поэтому выделение пузырьков газа (кипение) служит признаком окончания заряда аккумулятора.
При разрядке аккумулятора его ЭДС и напряжение падают. Если напряжение упадет ниже 1,7 В, на электродах начинается образование пленки PbSO4 особой кристаллической структуры (так называемое сульфатирование), которая изолирует электроды от электролита. Вследствие этого недопустимо снижение напряжения до 1,7 В.
Свинцовый аккумулятор обладает высоким КПД (≈ 80%), высокой ЭДС, простотой и невысокой ценой. Недостатки – небольшая удельная
энергия ≈ 20-30 Вт∙ч/кг и малый срок службы (от 2 до 5 лет).
Слайд 196
Топливный элемент
Разновидностью гальванического элемента является топливный элемент, в

котором химическая энергия окислительно-восстановительной реакции сгорания газообразного и жидкого
топлива превращается непосредственно в электрическую. Особенность топливных элементов состоит в том, что топливо и окислитель подводятся по мере их расходования. Это обеспечивает непрерывность работы источника тока теоретически в течение сколь угодно длительного времени. Одновременно и также непрерывно выводятся продукты окисления.
В качестве окислителя в топливных элементах почти всегда используется или чистый кислород или кислород воздуха. В качестве топлива применяются водород, гидразин, метанол, водяной и генераторный газы. Наибольшие успехи достигнуты в разработке водородно-кислородного топливного элемента.
Рассмотрим работу такого топливного элемента, который представляет собой два электрода специальной конструкции, погруженные в раствор щелочи (КОН). К поверхности одного из них непрерывно подводится водород (топливо), а к другому окислитель (кислород).
При замыкании внешней цепи на аноде протекает реакция окисления водорода: 2Н2 + 4ОН- = 4Н2О + 4е
На катоде восстанавливается кислород:
О2 + 2Н2О + 4е- = 4ОН-
По внешней цепи электроны перемещаются от анода к катоду, а в растворе цепь замыкается движением ионов ОН- от катода к аноду. Суммарное уравнение реакции сводится к получению воды.
2Н2 + О2 = 2Н2О
Для эффективной работы топливного элемента используются катализаторы, которые наносят на электроды.
Некоторые гальванические элементы, применяемые
в промышленности и на транспорте
Слайд 197
Важнейшей проблемой топливного элемента является кинетика электродных процессов

– даже при очень слабом токе напряжение на клеммах
источника быстро падает, так как элемент сильно поляризуется. Только большая скорость реакции окисления и восстановления позволяет получить довольно высокий коэффициент использования топлива. Для снижения поляризации топливного элемента используются пористые электроды с сильно развитой поверхность, изготовленные из порошков металлов или угля, обладающие каталитическим действием. В качестве катализаторов электродов используются металлы платиновой группы, серебро, специально обработанные никель и кобальт (поэтому топливные элементы еще являются дорогостоящими). Скорость электродных процессов можно также увеличить путем увеличения температуры и давления.
Топливные элементы вырабатывают постоянный ток низкого напряжения (1-1, 1 В), обеспечивают довольно высокий КПД 70% (по сравнению с тепловыми машинами), работают бесшумно и не выделяют вредных продуктов. Топливные элементы использовались в космических кораблях «Джемини» и «Апполон».
Слайд 198
Коррозия
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием

внешней среды.
Вред, причиняемый коррозией, весьма велик. По имеющимся данным,
примерно треть получаемого металла выбывает из технического употребления из-за коррозии.
В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим эффектом.
В некоторых случаях коррозия поражает всю поверхность, в других – часть ее. Характер разрушения зависит от свойств металла и условий протекания процесса. На рис. 7 представлены различные виды коррозийных разрушений: равномерное (а), пятнами (б), точечное (в), питтинг (г), межкристаллитное (д), растрескивающее (Е), селективное (Ж). Наиболее опасными являеются питтинг и межкристаллитное разрушения.
7. Виды коррозийный разрушений
По принципу их протекания все коррозийные процессы принято подразделять на: химические и электрохимические.
Слайд 199
Химическая коррозия
Химическая коррозия обусловлена взаимодействием металла с сухими

газами или жидкостями, не проводящими электрического тока. Химической коррозии
подвергаются детали и узлы машин, работающих в атмосфере кислорода, галогенов, при высоких температурах (турбинные, ракетные двигатели, оборудование химических производств).
Механизм реакции сравнительно прост. Продукты реакции образуются на тех участках металлической поверхности, которые вступили в реакцию. Так, на железе при 250-300оС появляется видимая пленка оксидов, при 600оС и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления (FeO, Fe3O4, Fe2O3). Окалина не может защитить металл от дальнейшего окисления, так как содержит трещины и поры, которые позволяют проникать кислороду к металлу. При повышении температуры свыше 800оС скорость окисления железа резко увеличивается.
Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению (образуется так называемая «защитная» пленка, которая препятствует проникновению к металлу как газов, так и жидкостей). Защитными свойствами обладает только та пленка, которая может покрывать сплошь весь металл. Расчеты показывают, что это возможно, если объем оксида металла больше объема самого металла, пошедшего на образование этого оксида:
Vокс / Vме>1
Для щелочных и щелочно-земельных металлов это условие не соблюдается (Vокс / Vме<1). Такие пленки защитными свойствами не обладают и эти металла ввиду своей химической активности принадлежат к числу коррозионно нестойких. На алюминии и хроме образуются хорошие защитные пленки, благодаря чему металлы в атмосферных условиях коррозийно стойки (хотя химически активны). Толщина таких пленок крайне мала, например, на алюминии она достигает только 100 Å. Такие пленки состоят всего из нескольких слоев молекул и могут быть обнаружены только специальными оптическими методами.
Если металл, покрытый пленкой, продолжает корродировать, то это означает, что имеет место диффузия атомов кислорода сквозь пленку к металлу, а атомов металла – в обратном направлении. Диффузия металла и кислорода в слое твердого защитного оксида может происходить по одному из двух возможных механизмов:
а) движение ионов в междоузельном пространстве кристаллической решетки;
б) движение ионов по пустым узлам решетки.
Первый механизм имеет место при образовании пленок ZnO, CdO, BeO, Al2O3; второй – Cu2O, FeO, NiO, CoO, ZrO2, TiO2.
Диффузия катионов в защитной пленке сопровождается одновременным перемещением в том же направлении эквивалентного числа электронов в междоузлиях при первом механизме и по «электронным дефектам» (катионом с более высокой валентностью) при втором механизме. При повышении температуры окисление металлов на воздухе происходит более интенсивно (увеличивается скорость диффузии).
Слайд 200
Электрохимическая коррозия
Разрушение металла при соприкосновении с электролитом

с возникновением в системе электрического тока называется электрохимической коррозией.
В
атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. В качестве примера рассмотрим действие серной кислоты на железо, содержащего примесь меди. При таком контакте возникает множество микроскопических гальванических элементов.
(-) Fe ׀ H2SO4 ׀ Cu(+)
= - 0,44 В
= 0,34 В
Более активный металл-железо – окисляется, посылая электроны атомам меди и переходит в раствор в виде ионов Fe2+, а ионы водорода разряжаются (восстанавливаются) на меди.
Помимо этого железо может растворяться и при непосредственном взаимодействием с кислотой (Fe + 2Н+ = Fe2+ + Н2↑), но опыт показывает, что скорость этой реакции мала по сравнению со скоростью растворения железа как анода гальванопары. Механизм коррозии в кислой и нетральной среде различен.
Рассмотрим коррозию технического железа на воздухе, когда оно покрыто влажной пленкой или находится в растворе электролитов с небольшой концентрацией гидроксид ионов. В качестве анода здесь служит основной металл – железо, катодом, являются примеси содержащиеся в металле, например, зерна графита:
Анод: Fe – 2e- = Fe2+
Катод: 2H2O + O2 + 4e- = 4OH-
Ионы OH- соединяются с перешедшими в раствор ионами Fe2+
Fe2+ + 2OH- = Fe(ОН)2
4Fe(ОН)2 + O2 + 2H2O = 4Fe(ОН)3
Fe(ОН)3 = Fe + H2O
Слайд 201
Согласно теории электрохимической коррозии при соприкосновении металла с

электролитом на его поверхности возникает множество микрогальванических элементов. При
этом анодами являются частицы металлов, катодами – загрязнения, примеси и участки металла, имеющие более положительный потенциал. Механическая обработка изменяет электродный потенциал, поэтому соприкосновение двух участков металла деформированного и недеформированного достаточно для появления разности потенциалов. Корродировать будет деформированный участок. Разность потенциалов возникает и там где соприкасаются обнаженный и покрытый пленкой участки.
Поскольку ионы и молекулы, связывающие электроны в катодном процессе, называют деполяризаторами, то часто говорят о водородной деполяризации в кислой и кислородной деполяризации в нейтральной и скабощелочной средах.
Поскольку электрохимическая коррозия обусловлена деятельностью гальванических элементов, можно сделать вывод, что факторы способствующие деятельности гальванических элементов усиливают коррозию. Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с ростом температуры и с увеличением концентрации окислителя в растворе.
Нередко продукты коррозии оказываются малорастворимыми в данной среде и своим присутствием защищают металл от дальнейшего разрушения. Например, железо в щелочных растворах, свинец в разбавленной серной кислоте коррозионно стойки вследствие образования пленок Fe(OH)2, PbSO4.
Большое значение в процессах коррозии имеют поляризация электродов, образование пленок на металлах, пернапряжение водорода. Если бы в коррозионных процессах не происходило поляризации электродов (см. поляризация), то процессы коррозии протекали бы с такой скоростью, что железо и ряд других металлов потеряли бы свое значение в технике.
Подземная коррозия
Под влиянием веществ, растворимых в почве или под действием блуждающих токов, происходит разрушение газо- и нефтепроводов, оболочек кабелей, металлических конструкций, свай (почвенная коррозия). Интенсивность почвенной коррозии зависит от агрессивно действующих кислот, органических соединений и от деятельности бактерий. Наиболее активными считаются торфянистые и болотистые почвы. Под действием блуждающих токов, исходящих от электроустановок, работающих на постоянном токе, трамваев, метро, электрических железных дорог. Блуждающие токи вызывают появление на металлических предметах (трубопроводах, кабелях, рельсах участков входа и выхода постоянного тока, т.е. образование катодных и анодных зон на металле (анодные зоны – места выхода тока подвергаются коррозии. Блуждающие токи от источников переменного тока вызывают слабую коррозию изделий из стали и сильную – у изделий из цветных металлов.
Резко увеличивают коррозию ионы хлора, брома, йода.
Методы защиты от коррозии
Слайд 202
Классификация коррозионных сред
Среда, в которой металл

подвергается коррозии (коррозирует) называется коррозионной
или агрессивной средой. По степени воздействия на металлы коррозионные среды целесообразно разделить на:
неагрессивные;
слабоагрессивные;
среднеагрессивные;
сильноагрессивные.
Для определения степени агрессивности среды при атмосферной коррозии необходимо учитывать условия эксплуатации металлических конструкций зданий и сооружений. Степень агрессивности среды по отношению к конструкциям внутри отапливаемых и неотапливаемых зданий, зданий без стен и постоянно аэрируемых зданий определяется возможностью конденсации влаги, а также температурно-влажностным режимом и концентрацией газов и пыли внутри здания. Степень агрессивности среды по отношению к конструкциям на открытом воздухе, не защищенным от непосредственного попадания атмосферных осадков, определяется климатической зоной и концентрацией газов и пыли в воздухе. С учетом влияния метеорологических факторов и агрессивности газов разработана классификация степени агрессивности сред по отношению к строительным металлическим конструкциям. С учетом влияния метеорологических факторов и агрессивности газов разработана классификация степени агрессивности сред по отношению к строительным металлическим конструкциям, которые представлены в таблице:
Слайд 203
Таким образом, защита металлических конструкций от коррозии определяется
агрессивностью условий их эксплуатации. Наиболее надежными защитными системами металлических
конструкций являются алюминиевые и цинковые покрытия.



































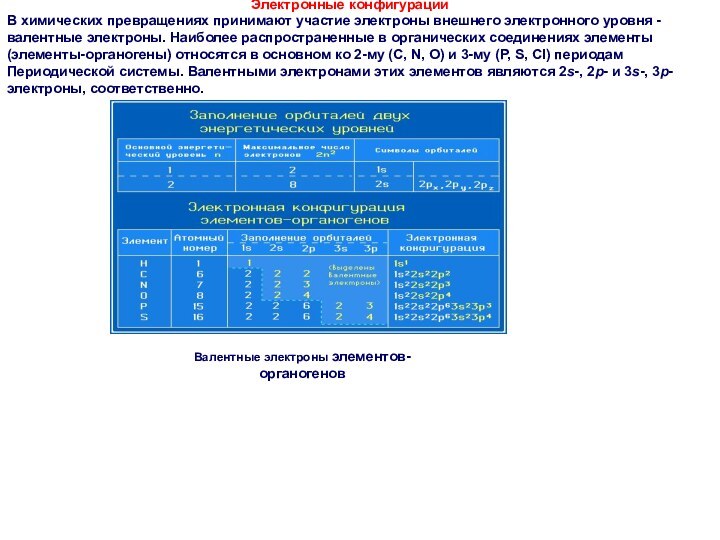

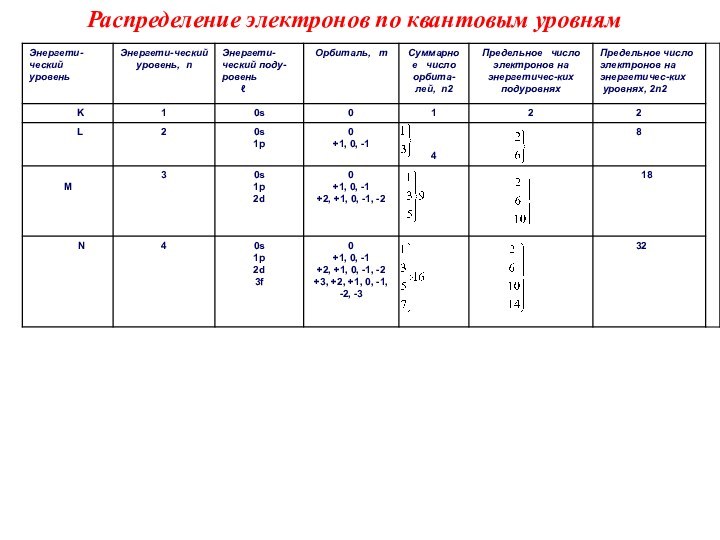








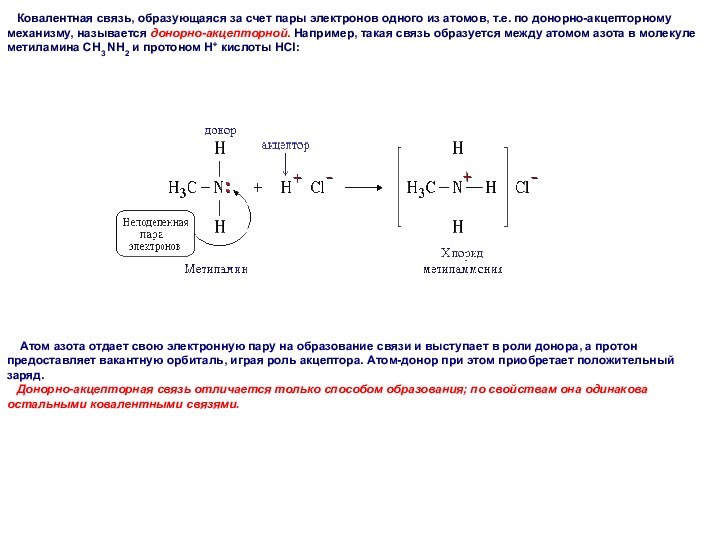

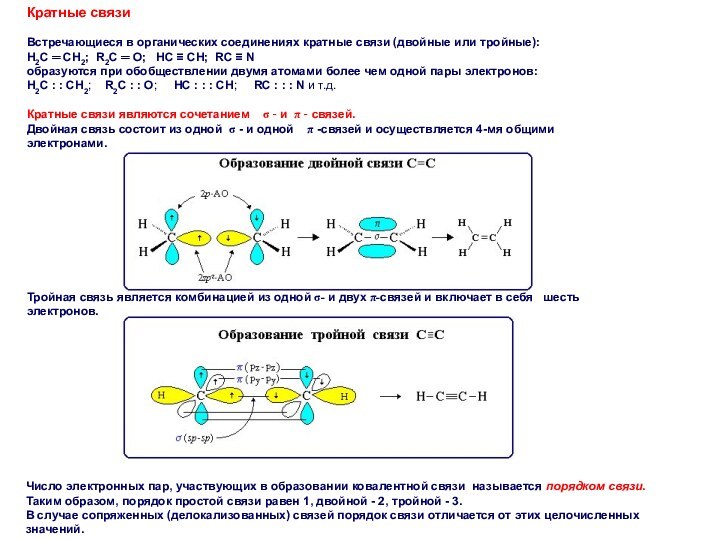



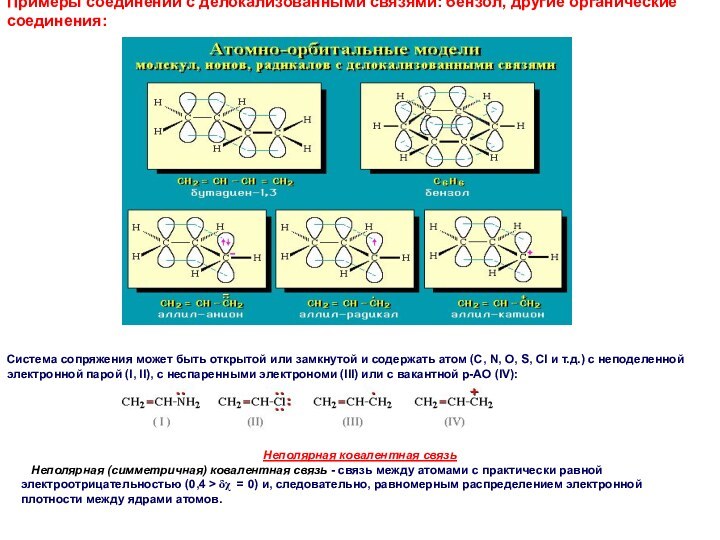



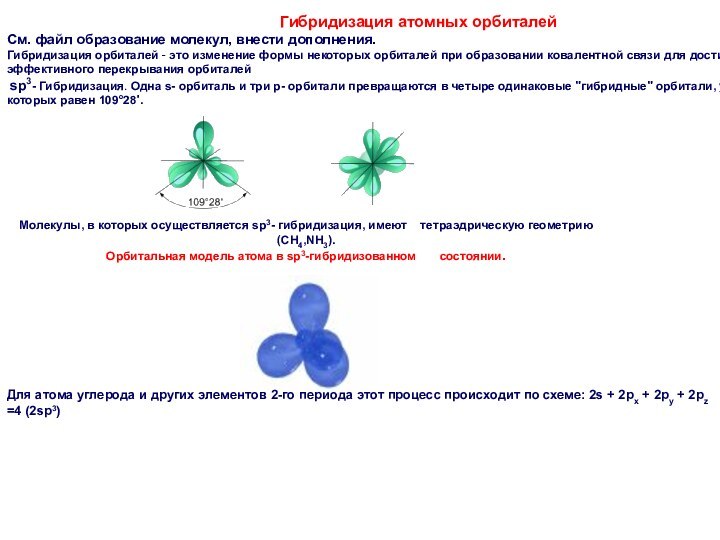
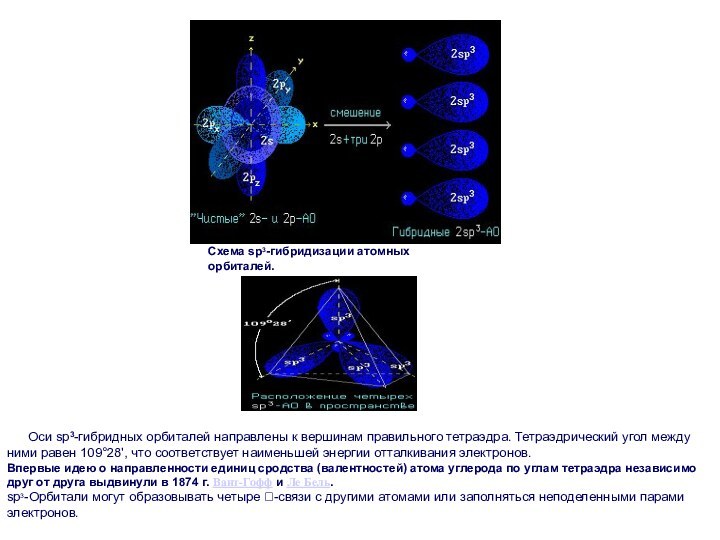





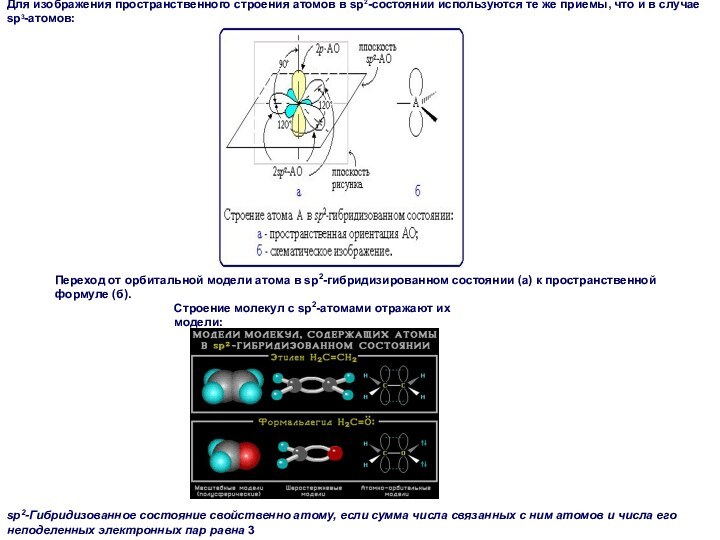


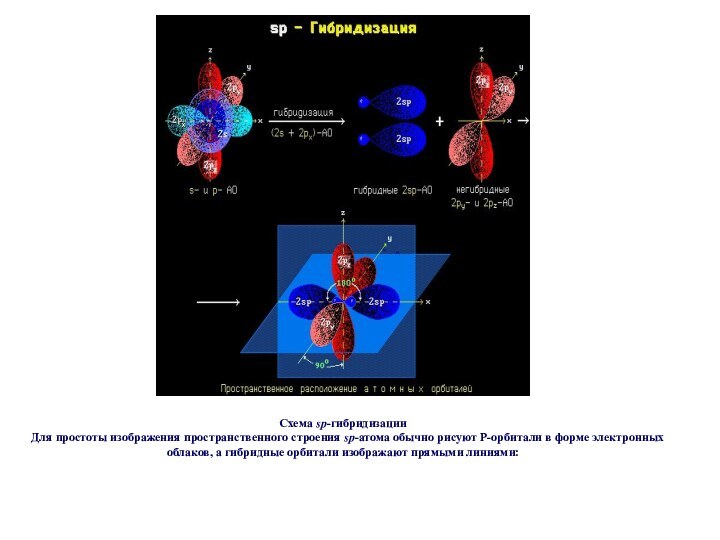

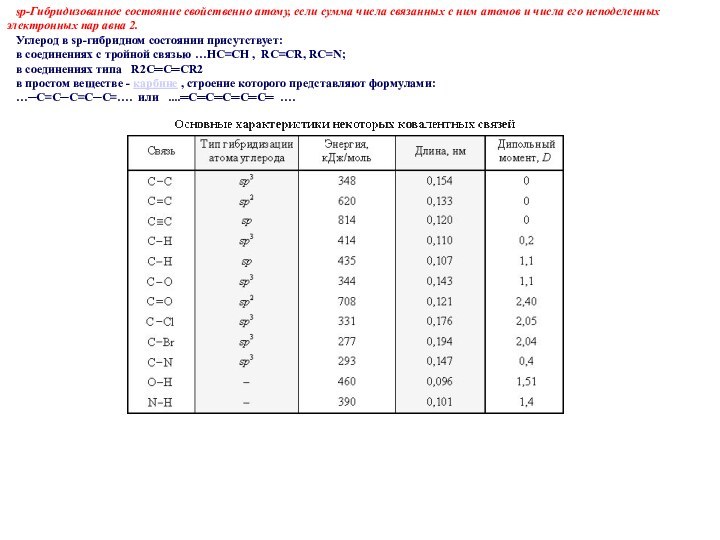










![Химия Например, надо разрушить устойчивый ион[Ag(NH3)2]+, имеющий Кн = 10-8. Если на](/img/tmb/11/1077522/728da84c8e6d3360eb9240187db1a9cb-720x.jpg)



















































![Химия ПолучениеЭлектролиз расплава Al2O3 (в присутствии криолита Na3[AlF6]): 2Al2O3 => 4Al + 3O2Химические](/img/tmb/11/1077522/5bcbb7bb136344d714fdf057c437fe71-720x.jpg)

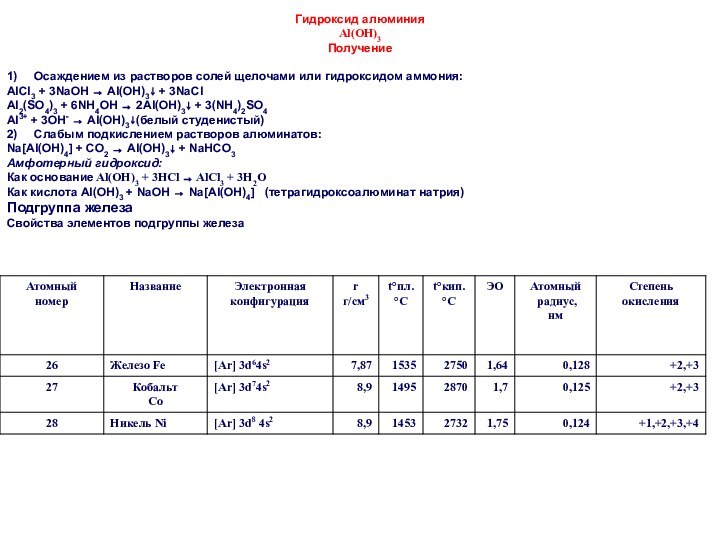




![Химия Качественные реакции на Fe3+ 1) При действии гексацианоферрата (II) калия K4[Fe(CN)6]](/img/tmb/11/1077522/f1fe3603d3a772b460b38ff293a12b3a-720x.jpg)