- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Элементы 6 группы.Кислород (9 класс)
Содержание
- 2. Сегодня мы продолжим разговор о неметаллах, речь
- 3. киноварь HgSхалькопирит CuFeS2галенит PbSпирит FeS2самородная сера Sгипс СаSO4.2H2O
- 4. ХАЛЬКОГЕНЫ – рождающие рудыOSSeTePo
- 5. ТЕМА: ОБЩАЯ ХАРАКТЕРИСТИКА 6 группы. КИСЛОРОДЦЕЛИ УРОКА:
- 6. Халькогены являются неметаллами, проявляют окислительные свойстваO
- 7. Давайте распишем электронную и графическую конфигурации для атомов кислорода и серы
- 8. В группе сверху вниз окислительные свойства халькогенов ослабевают, восстановительные свойства усиливаются за счёт увеличения радиуса атома
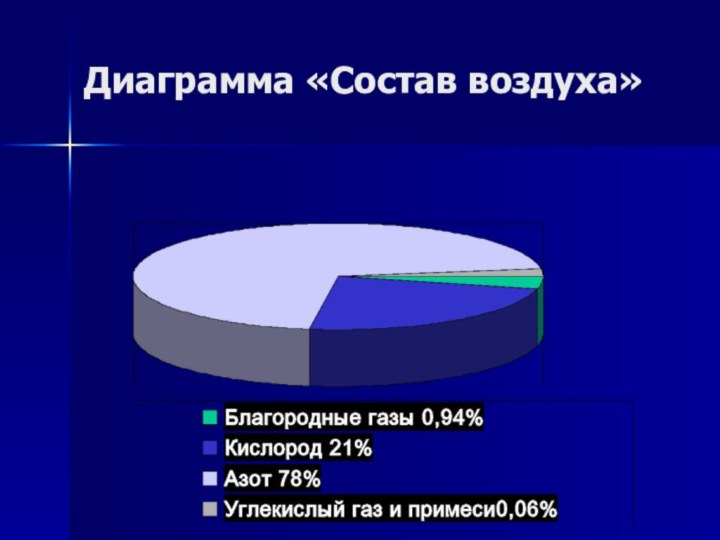
- 9. Диаграмма «Состав воздуха»
- 10. Практически на каждом уроке мы встречаемся с кислородом. Вспомните, характерно ли для кислорода явление аллотропии?
- 11. КИСЛОРОД И ОЗОН
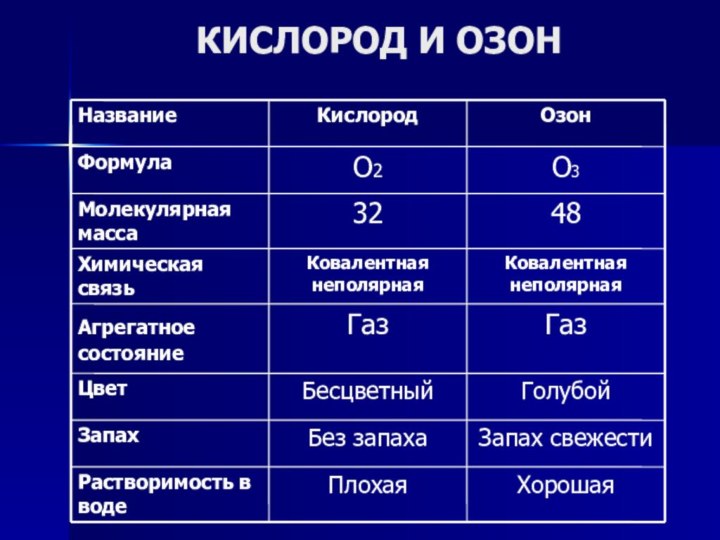
- 12. КИСЛОРОД И ОЗОН
- 13. Озоновый слой Земли
- 14. Разрушение озонового слоя:O3 + NO NO2 + O2
- 15. На одной из площадей Лондона установлен памятник
- 17. Портрет Джозефа ПристлиДжозеф Пристли как-то разОксид ртути
- 18. Запишите уравнение той реакции, которую осуществил Пристли
- 19. А сейчас задание по группам:Группа №1:способы получения
- 20. Что же является главным поставщиком кислорода на планете?
- 21. ПОЛУЧЕНИЕ КИСЛОРОДА:1 Разделение воздуха2 2H2O
- 22. А сейчас мы переходим к химическим свойствам
- 23. Фотосинтез
- 24. Химические свойства О2 :При взаимодействии с металлами
- 25. А сейчас задание по группам:Группа №1:Записать 2
- 26. Кислород реагирует со сложными веществами:SO2 + O2CH4 + O2
- 27. Как вы думаете, всегда ли кислород выступает
- 28. Кислород – восстановитель :
- 29. Химическая активность озонаO3 O2 + O
- 30. Химические свойства озона:O3 + 2 Ag н.у. AgO2 + O2
- 31. Из – за своей сильной окислительной способности кислород разрушает изделия из металла, этот процесс называют …
- 32. Царь - колоколМногие памятники культуры:Царь колокол,Царь пушка
- 33. Царь - пушкаМногие памятники культуры:Царь колокол,Царь пушка
- 34. Давайте запишем уравнение реакции разрушения этих памятников
- 35. Многие памятники ученым и писателям, купола храмов разрушаются под действием атмосферы, и в том числе кислорода.
- 36. Новодевичий монастырь
- 37. Колокольня Ивана Великого
- 38. Храм Христа Спасителя
- 39. Давайте вместе с вами подведем итог нашему сегодняшнему уроку
- 40. Скачать презентацию
- 41. Похожие презентации
Сегодня мы продолжим разговор о неметаллах, речь пойдет о элементах 6 группы главной подгруппы. Перечислите мне эти элементы Все эти элементы имеют общее название «халькогены», что в переводе с греческого языка означает «рождающие руды», и




































Слайд 6
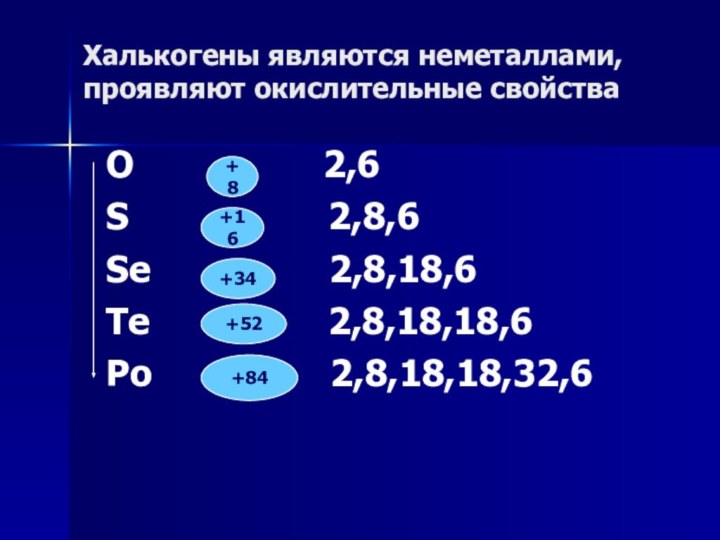
Халькогены являются неметаллами, проявляют окислительные свойства
O
2,6
S
2,8,6Se 2,8,18,6
Te 2,8,18,18,6
Po 2,8,18,18,32,6
+8
+16
+34
+52
+84
Слайд 8 В группе сверху вниз окислительные свойства халькогенов ослабевают,
восстановительные свойства усиливаются за счёт увеличения радиуса атома
Слайд 10
Практически на каждом уроке мы встречаемся с кислородом.
Вспомните, характерно ли для кислорода явление аллотропии?
Слайд 15
На одной из площадей Лондона установлен памятник ученому
– химику, он изображен с лупой в руке, с
помощью которой он фиксирует солнечные лучи.КТО ЭТО???
Слайд 17
Портрет Джозефа Пристли
Джозеф Пристли как-то раз
Оксид ртути нагревая,
Обнаружил
странный газ,
Газ без цвета, без названья,
Ярче в нём горит
свеча,А не вреден для дыханья?
Не узнаешь у врача.
Новый газ из колбы вышел,
Никому он не знаком,
Этим газом дышат мыши
Под стеклянным колпаком.
«Человек им тоже дышит»-
Джозеф Пристли быстро пишет.
Кошка греется на крыше,
Солнца луч в окошко бьёт.
Джозеф Пристли, с ним две мыши
Получают кислород.
Слайд 19
А сейчас задание по группам:
Группа №1:способы получения кислорода
в промышленности
Группа № 2: способы получения кислорода в лаборатории
Слайд 21
ПОЛУЧЕНИЕ КИСЛОРОДА:
1 Разделение воздуха
2 2H2O
2H2 + O2
3 2H2O2 2H2O
+ O2 4 2KNO3 2KNO2 + O2
5 2KMnO4 K2MnO4 + MnO2 + O2
э.т.
MnO2
t
t
Слайд 22
А сейчас мы переходим к химическим свойствам кислорода
Реагирует
ли кислород с простыми веществами? Как называются продукты реакции?
Слайд 24
Химические свойства О2 :
При взаимодействии с металлами и
неметаллами О2 проявляет окислительные свойства, т.к. присоединяет электроны и
понижает свою степень окисления в ходе химических реакций
Слайд 25
А сейчас задание по группам:
Группа №1:Записать 2 уравнения
реакции получения основного и амфотерного оксидов
Группа № 2:Записать 2
уравнения реакции получения солеобразующего и несолеобразующего оксидовСлайд 27 Как вы думаете, всегда ли кислород выступает в
роли окислителя?
С какими веществами он будет реагировать, проявляя восстановительные
свойства?( подсказка – шкала электроотрицательности )





























