Слайд 2
Общая характеристика кремния по положению в периодической системе
Порядковый
номер – 14, заряд ядра +14, протонов в ядре
– 14, электронов – 14.
Номер периода III – 14 электронов движутся по трём энергетическим уровням.
Номер группы IV – на внешнем энергетическом уровне находятся 4 электрона.
Радиус атома больше чем у углерода – увеличивается способность к отдаче электронов.
Увеличиваются металлические и восстановительные свойства (в сравнении с углеродом).
C
Si Ge Sn Pb
Слайд 3
Строение атома кремния
Е
Е
Si
+14
2e
8e 4e
1s 2s 2p 3s 3p
2
2
2
2
6
Возбуждённое состояние
3s
3p
3d
3s
3p
3d
Слайд 4
До завершения внешнего уровня кремнию не хватает 4
электронов.
В соединениях может проявлять степени окисления +4,
-4.
4Na + Si = Na4Si
Si0 + 4e- = Si-4 пр.Red ; Ox
Na0 - 1e- = Na+1 пр.Ox ; Red
Si + O2 = SiO2
Si0 – 4e- = Si+4 пр.Ox ; Red
2O0 + 2e- = 2O-2 пр.Red ; Ox
Слайд 6
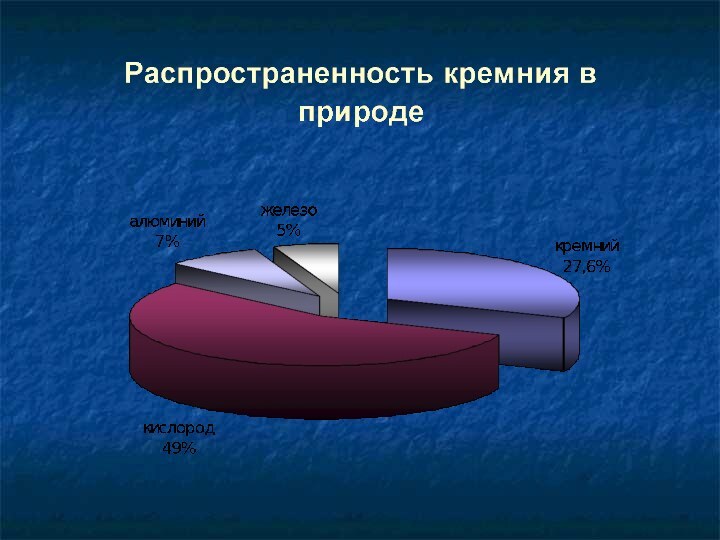
Кремний в природе
В свободном виде не встречается. Встречается,
преимущественно, в виде диоксида кремния (SiO2), другое
его название кремнезем.
В виде SiO2 входит в состав растительных и животных организмов.
В природе образует минерал кварц, который
имеет разновидности, такие, как горный
хрусталь, агат, опал, яшма, халцедон, сердолик.
Слайд 7
Один из типов природных соединений кремния – силикаты.
Среди
них наиболее распространены алюмосиликаты. К
алюмосиликатам относятся гранит, глина,
слюда.
К силикатам, не содержащим алюминий, относится асбест.
Слайд 8
Значение для живых организмов
Важнейшее соединение кремния – оксид
SiO2 необходим для жизни растений и животных.
Он
придаёт прочность стеблям растений и защитным покровам животных.
Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем.
У человека кремний придаёт гладкость и прочность костям
Слайд 9
История открытия кремния
Кремний был открыт в 1811 году
Гей – Люссаком и Тенаром, но он был слишком
загрязнён примесями.
В 1825 году был получен чистый кремний шведским химиком Берцелиусом.
Слайд 10
Получение кремния
В лабораториях кремний получают, восстанавливая оксид кремния
SiO2 магнием.
SiO2 + 2Mg = 2MgO + Si
Si+4 + 4e- = Si0 пр. Red ; Ox
Mg0 - 2e- = Mg+2 пр. Ox ; Red
В промышленности получают в электрических печах, коксом восстанавливая SiO2 или разложением силана.
SiO2 + 2C = 2CO + Si (1900 0)
Si+4 + 4e- = Si0 пр. Red ; Ox
C0 - 2e- = C-2 пр. Ox ; Red
SiH4 = Si + 2H2 (400 0)
Si-4 - 4e- = Si0 пр. Ox ; Red
2H+1 + 1e- = 2H0 пр. Red ; Ox
Слайд 11
Кремний – простое вещество
В реакциях выступает в роли окислителя :
В этом
случае он взаимодействует с металлами и водородом.
В реакциях выступает в роли восстановителя:
В этом случае он будет взаимодействовать с более электроотрицательными веществами (O2 , Cl2 Br2 )
Кристаллическое вещество тёмно-серого цвета, полупроводник.
За счёт кристаллической решётки, он очень твёрдый.
Слайд 12
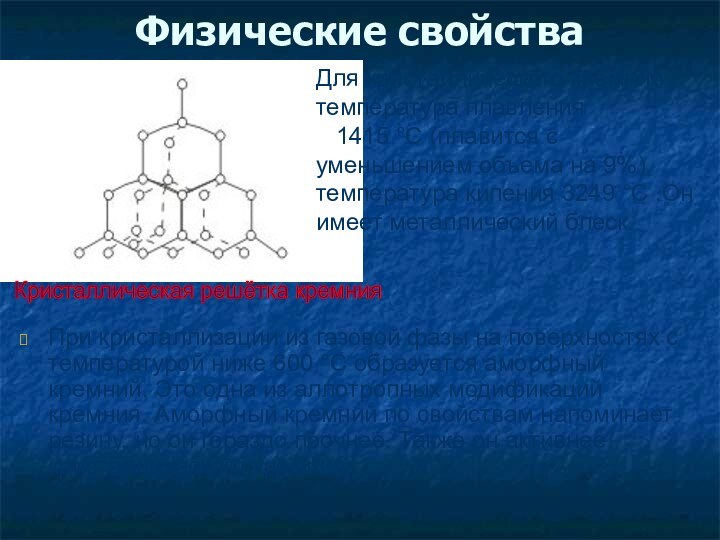
Физические свойства
При кристаллизации из газовой фазы на поверхностях
с температурой ниже 600 °С образуется аморфный кремний. Это
одна из аллотропных модификаций кремния. Аморфный кремний по свойствам напоминает резину, но он гораздо прочнее. Также он активнее кристаллического кремния.
Кристаллическая решётка кремния
Для кристаллического кремния температура плавления
1415 °С (плавится с уменьшением объема на 9%), температура кипения 3249 °С .Он имеет металлический блеск.
Слайд 13
Оксид кремния (IV)
Оксид кремния IV – кислотный оксид,
отличается от других кислотных оксидов тем, что не взаимодействует
с водой, кремниевая кислота нерастворима в воде.
Обладает всеми свойствами кислотных оксидов: взаимодействует с основными оксидами и основаниями.
Отличается высокой температурой плавления и довольно низкой химической активностью. активностью.
Кристаллическая решетка
Оксида кремния (IV)
Слайд 14
В соединениях кремний проявляет степени окисления +4,
0, -4.
Он химически мало активен, большей
активностью обладает аморфный кремний.
При повышении температуры активность его увеличивается, и он вступает в реакцию с металлами, неметаллами, со сложными неорганическими веществами.
Si
С ЩЕЛОЧАМИ
С НЕМЕТАЛЛАМИ
С МЕТАЛЛАМИ
Слайд 15
Взаимодействие с металлами
Кремний растворим в расплавах металлов,
причём с некоторыми из них ( Zn, Al, Sn,
Pb, Ag, Au и т.д.)
не реагирует, а с другими (Na, K, Ca и т.д.) – образует силициды
4Na + Si = Na4 Si – сплавление
Na0 - 1e- = Na+1 пр. Ox ; Red
Si0 + 4e- = Si-4 пр. Red ; Ox
Слайд 16
Кремний взаимодействует с неметаллами, которые более электроотрицательны, и
с галогенами.
Si + O2 = SiO2
Si0 – 4e- = Si+4 пр. Ox ; Red
2O0 + 2e- = 2O-2 пр. Red ; Ox
Si + 2Cl2 = SiCl4
Si0 – 4e- = Si+4 пр. Ox ; Red
2Cl0 + 1e- = 2Cl-1 пр. Red ; Ox
Взаимодействие с неметаллами
Слайд 17
Со щелочами взаимодействует при малых количествах ионов ОН
–
(Возможен гидролиз стекла при хранении щелочей в стеклянной
посуде).
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Si0 – 4e- = Si+4 пр. Ox ; Red
2H+1 + 1e- = 2H0 пр. Red ; Ox
Взаимодействие со щелочами
Слайд 18
СИЛИЦИДЫ
Твёрдые вещества неустойчивые по отношению к воде
и растворам
кислот, под действием которых необратимо
гидролизуют с выделением силана.
Mg2Si +
4H2O = Mg(OH)2↓ + SiH4↑
Mg2Si+ 4HCl = 2MgCl2 + SiH4
Mg2Si + 4H+ = 2Mg2+ + SiH4
Слайд 19
Силикаты – соли кремниевой кислоты
Силикаты можно получить сплавлением
диоксида кремния с оксидами металлов или с карбонатами.
Силикаты
натрия и калия называют растворимым стеклом.
Их водные растворы – хорошо известный силикатный клей.
SiO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
Слайд 20
Кремниевая кислота
Действием на силикаты сильными кислотами(HNO3 , H2SO4)
получают кремниевую кислоту H2SiO3 . Она очень слабая и
нерастворима в воде (выпадает в виде студенистого осадка, иногда заполняющего весь объём раствора, превращая его в желе).
При высыхании его образуется силикагель,
широко применяемый в качестве адсорбента – поглотителя других веществ.
Силикагель
Слайд 21
ПРИМЕНЕНИЕ
Кремний применяют для полупроводниковых материалов, а также для
кислотоупорных сплавов.
Из расплавленного кварца делают химическую посуду.
Из
каолина и нефелина получают алюминий. Из глины делают цветочные горшки и посуду.
Из песка делают стекло. Не менее важным продуктом является цемент.
Кремний используется в солнечных батареях.
Слайд 22
При сплавлении кварцевого песка с углём
при
высоких температурах образуется карбид кремния SiC ,который по твёрдости
уступает только алмазу. Поэтому его используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней. Хотя уже в глубокой древности люди использовали кремний в соединениях, потому что при сколах он образовывал режущие края.
Слайд 23
Силикатная промышленность
Силикатная промышленность – отрасль промышленности, занимающаяся переработкой
природных соединений кремния.
Область применения кремния очень велика. Из него
получают
оконное, ламповое, зеркальное и другие виды стекла.
Другим важным материалом, на основе соединений кремния,
является цемент. Его получают спеканием известняка и глины
в специальных печах.
Всем этим занимается силикатная промышленность, а ещё
производством кирпича, фарфора, фаянса.
Слайд 24
Фарфор – керамический материал, состоящий из каолина, обычной
глины, кварца и полевого шпата. Фарфор белого цвета, не
имеет пористости, обладает высокой прочностью, химической и термической стойкостью.
Фаянс – керамический материал, отличный от фарфора тем, что содержит 85% глины, обладает высокой пористостью и водопоглощением.
Стекло – твёрдый силикатный материал, основными свойствами которого являются прозрачность и химическая стойкость. Стекло получают варкой шихты (смесь из песка, соды и известняка) в специальных печах.
Цемент – вяжущие вещества, употребляемые в строительстве для скрепления между собой твёрдых предметов. Цементы различают на воздушные и гидравлические. В технике цементом называют только гидравлические.