Слайд 4
Строение атома
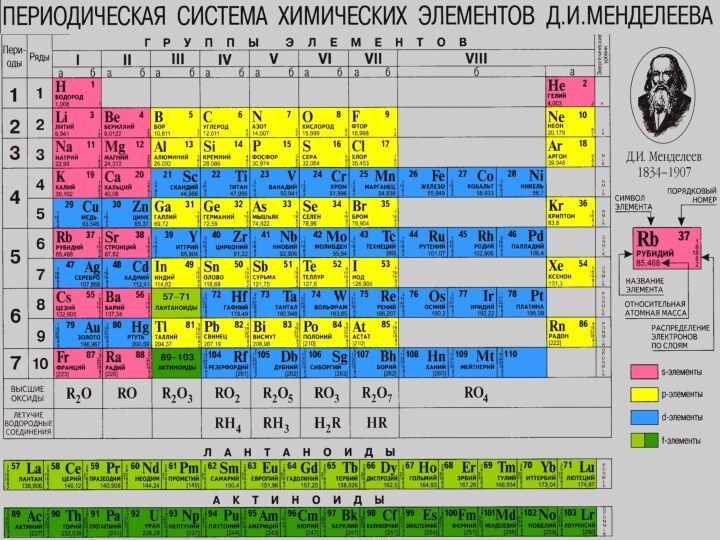
Положение в ПС: период III; группа IV,
главная;
Заряд ядра: +14 Si;
Относительная атомная масса: Ar (Si)=28
Строение атома:
p=14, e=14, n=28 - 14 =14
Электронная формула: +14 Si 2e;8e;4e;
+14 Si 1s2 2s2 2p6 3s2 3p2
Неметалл;
Слайд 5
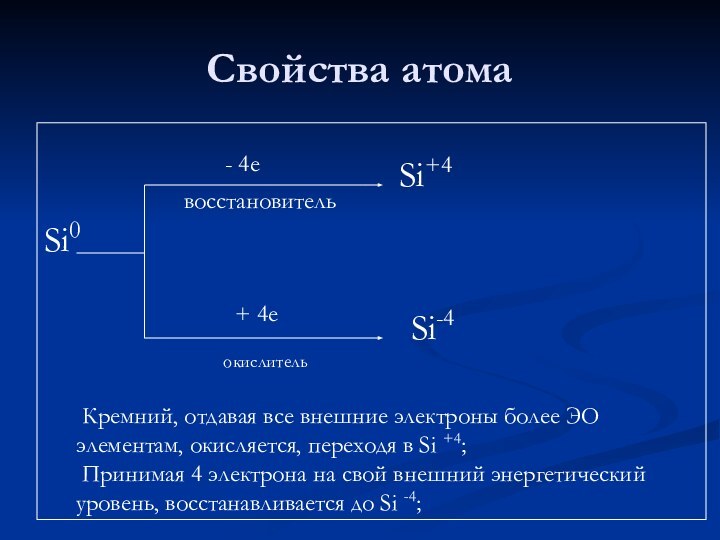
Свойства атома
Si0
- 4е
восстановитель
+ 4е
окислитель
Si+4
Si-4
Кремний, отдавая все внешние
электроны более ЭО элементам, окисляется, переходя в Si +4;
Принимая 4 электрона на свой внешний энергетический уровень, восстанавливается до Si -4;
Слайд 7
Физические свойства кремния
Кремний – неметалл, существует в кристаллическом
и аморфном состоянии.
Кристаллический кремний – вещество серовато – стального
цвета с металлическим блеском, весьма твердое, но хрупкое. Аморфный кремний – бурый порошок.
р = 2,33 г/см3; t пл. = 14150С; tкип. = 35000С;
Слайд 8
Кристаллическая структура кремния
Кристаллическая решетка
кремния кубическая
гранецентрированная
типа алмаза.
Но из-за большей длины связи
между
Si – Si, твердость кремния значительно меньше, чем алмаза.
Кремний хрупок, только при нагревании выше 8000С.
Слайд 9
Электрофизические свойства
Элементарный кремний —
типичный полупроводник.
На электрофизические свойства
кристаллического
кремния большое
влияние оказывают содержащиеся
в нем микропримеси.
Для получения монокристаллов кремния
с дырочной проводимостью в кремний
вводят добавки элементов III-й группы —
бор, алюминия, галлия и индия, с электронной проводимостью —
добавки элементов V-й группы — фосфора, мышьяка или сурьма.
Слайд 10
Кремний в природе
Кремний в свободном виде в природе
не встречается.
Кремний – второй по распространенности элемент ПСХЭ.
В природе
встречается в
виде кремнезема (SiO2), силикатов и алюмосиликатов.
Кремень, именно этот
невзрачный и очень
прочный камень,
положил
начало каменному
веку – веку
кремневых орудий труда.
Причин две:
- распространенность и доступность кремния;
- способность образовывать при сколе острые режущие края;
Слайд 12
Разновидности минералов на основе оксида кремния
Агат
Горный
хрусталь
Кварц
Цитрин
Кошачий
глаз
Аметист
Яшма
Сердолик
Опал
Слайд 13
Знаете ли вы, что…
В чистом виде кремний был
выделен
в 1811 году французскими учеными:
Жозеф Луи Гей-Люссак
Луи
Жаком Тенор
Слайд 14
Знаете ли вы, что..
Кремний в элементарном состоянии
был впервые получен в 1825 году шведским химиком Йенсом
Якобсом Берцелиусом
Слайд 15
Знаете ли вы, что…
Русское название «кремний»
введено в 1834 г.
российским химиком
Германом Ивановичем
Гессом.
Слайд 16
Знаете ли вы, что..
Способ получения кремния
в чистом
виде разработан
Николаем Николаевичем
Бекетовым.
Кремний в России производится
на заводах:
г. Каменск - Уральский (Свердловская область)
г. Шелех (Иркутская область).
Слайд 17
Получение кремния
В промышленности кремний получают восстанавливая расплав SiO2
коксом при
t = 18000C в дуговых печах. Чистота
полученного таким образом кремния составляет 99,9 %.
Слайд 18
Получение кремния
Лабораторный способ получения:
SiO2 + 2 Mg
? 2MgO + Si
Слайд 19
Химические свойства кремния
Химически кремний малоактивен.
При комнатной температуре
реагирует только c фтором, образуя летучий тетрафторид кремния:
Si + 2F2? SiF4
Слайд 20
Химические свойства кремния
При нагревании до 400 – 5000С
кремний реагирует с кислородом с образованием диоксида кремния:
Si + O2 ? SiO2
Слайд 21
Химические свойства кремния
с хлором, бромом и йодом —
с
образованием соответствующих
легко летучих тетрагалогенидов SiHal4:
Si + 2Cl2 ? SiCl4
Si + 2Br2 ? SiBr4
Слайд 22
Химические свойства кремния
При взаимодействии с металлом, кремний проявляет
себя как окислитель.
При взаимодействии образуются: силициды.
2Са + Si? Ca2Si
Кремний легко растворяется в щелочах.
Слайд 23
Химические свойства кремния
С водородом кремний непосредственно не реагирует.
Водородное
соединение силан, получают косвенным способом, при взаимодействии силицидов с
кислотами:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Слайд 28
Применение кремния и его соединений
Стекло
Цемент
Кирпич
Фарфор
Фаянс
Клей
Силикон
Асбест
Гранит
Керамика
Слайд 31
Биологическая роль
Важнейшее соединение кремния – SiO2 необходим для
жизни растений и животных.
Благодаря ему тростники, камыши
и хвощи стоят крепко, как штыки.
Острые листья осоки режут, как
ножи, стерня на скошенном поле
колет, как иголки, а стебли злаков
настолько крепки, что не позволяют
ниве на полях ложиться от дождя и ветра
Слайд 32
Биологическая роль
Чешуя рыб, панцири насекомых, крылья бабочек, перья
птиц и шерсть животных прочны, так как содержат кремнезем.
Слайд 33
Биологическая роль
Кремний придаёт гладкость и прочность костям и
кровеносным сосудам человека.
В организме человека кремния менее 0,01% по
весу.
Слайд 34
Кремний - микроэлемент, постоянно
содержащийся в организме человека. Наибольшее его количество содержится в
лимфоузлах, соединительной ткани аорты, трахеи, в волосах и коже. Кремний необходим для построения эпителиальных клеток.
Кремний играет важную роль в процессе минерализации костной ткани; необходим для поддержания эластичности стенки артерий, оказывает положительное влияние на иммунитет и замедляет процессы старения в тканях организма человека.
Среднее содержание кремния в крови составляет 8,25 мг/сутки. С возрастом его уровень в организме снижается, поэтому у пожилых людей потребность в кремнии, как правило, повышается. Улучшают усвоение кремния организмом наличие кальция, магния, марганца и калия.
Слайд 35
Биологическая роль
Кремний входит и
в состав низших живых организмов – диатомовых водорослей и
радиолярий, - нежнейших комочков живой материи, которые создают свои непревзойденные по красоте скелеты из кремнезема.
Диатомовые водоросли
Радиолярии