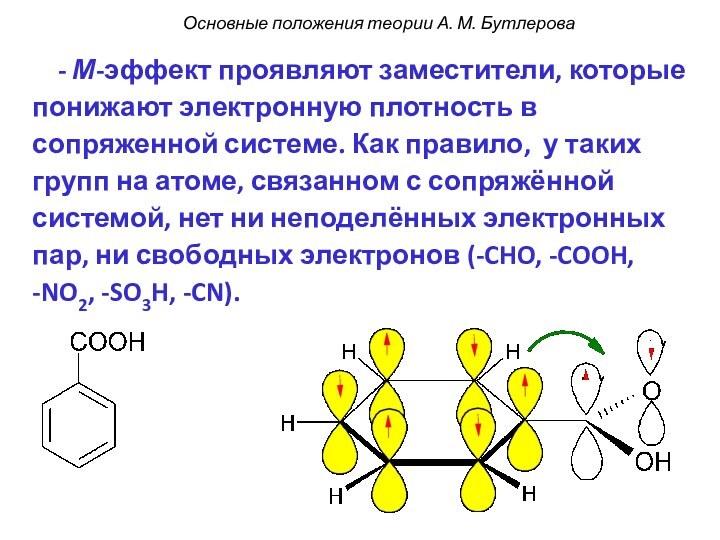
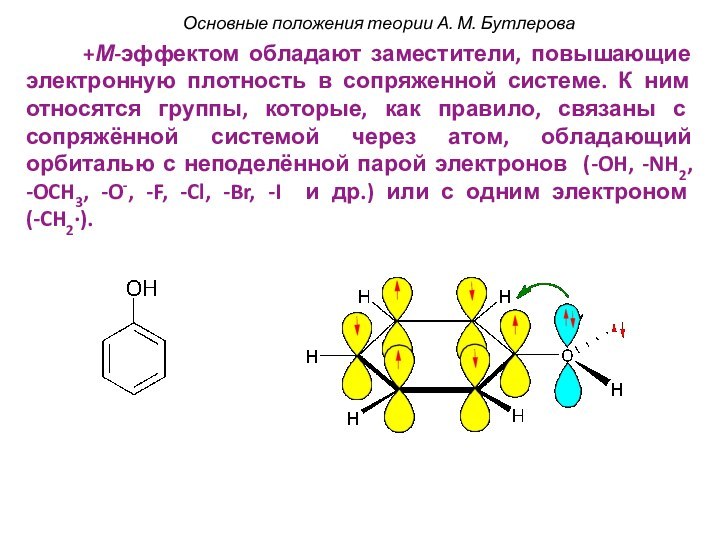
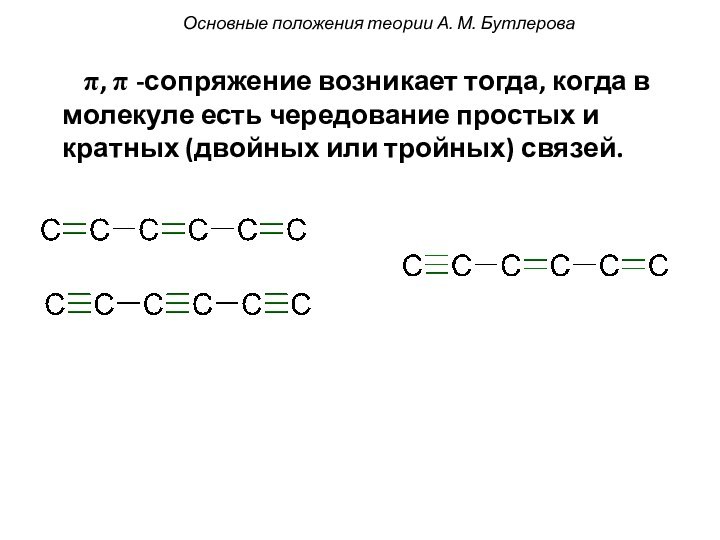
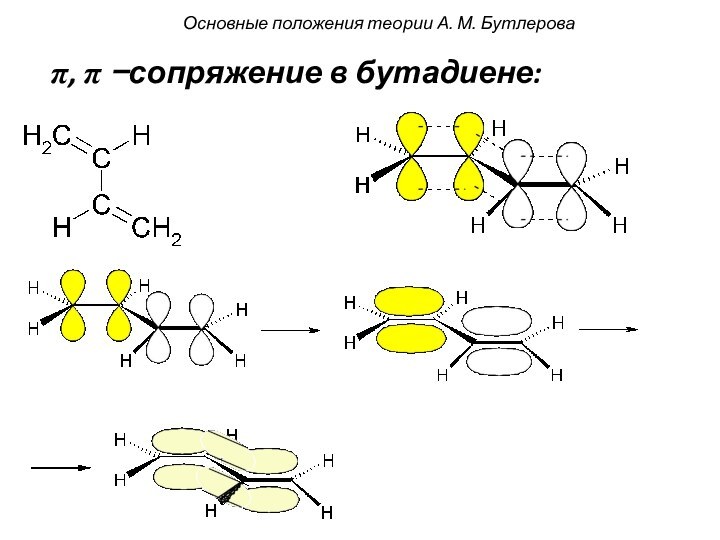
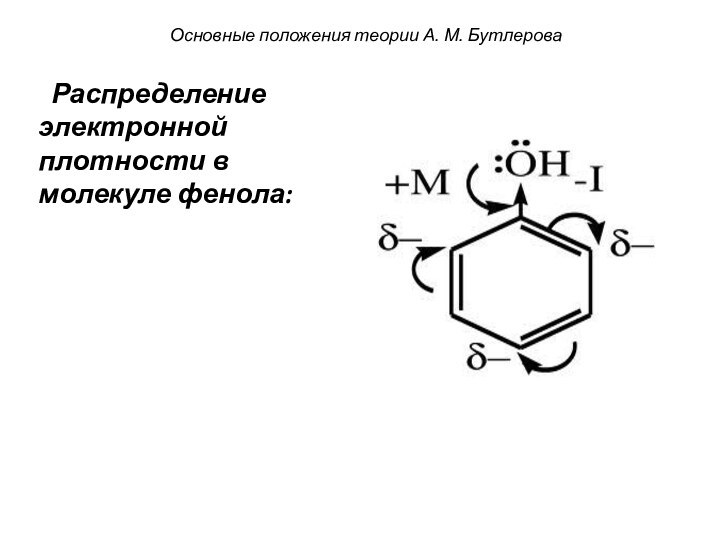
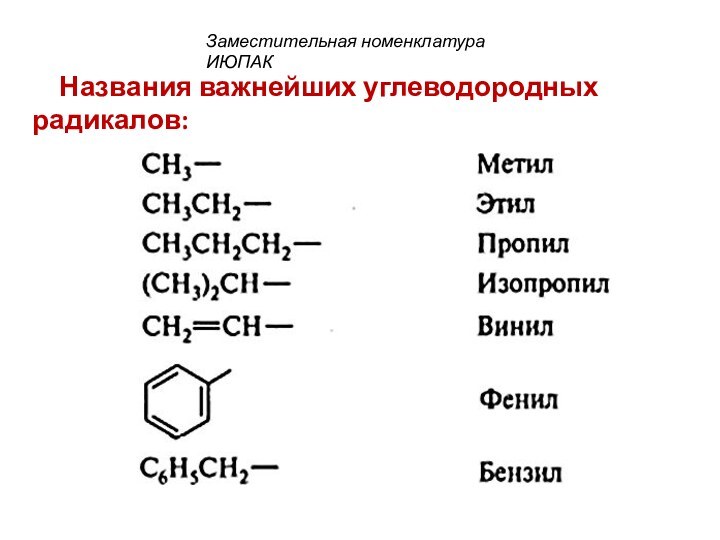
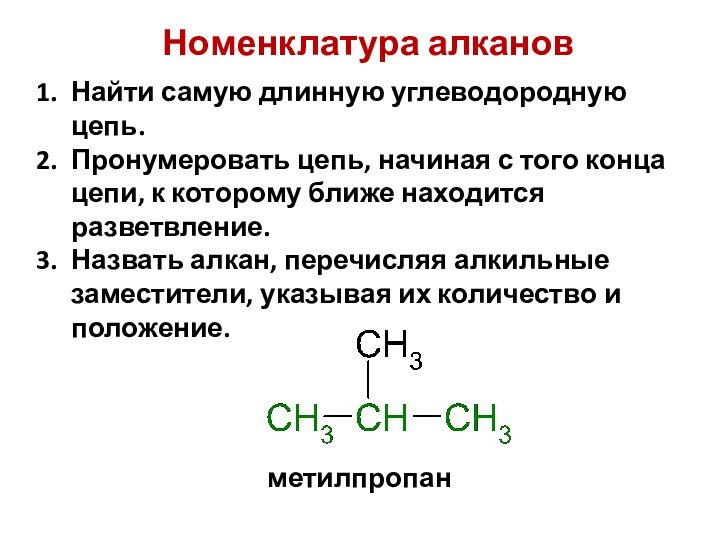
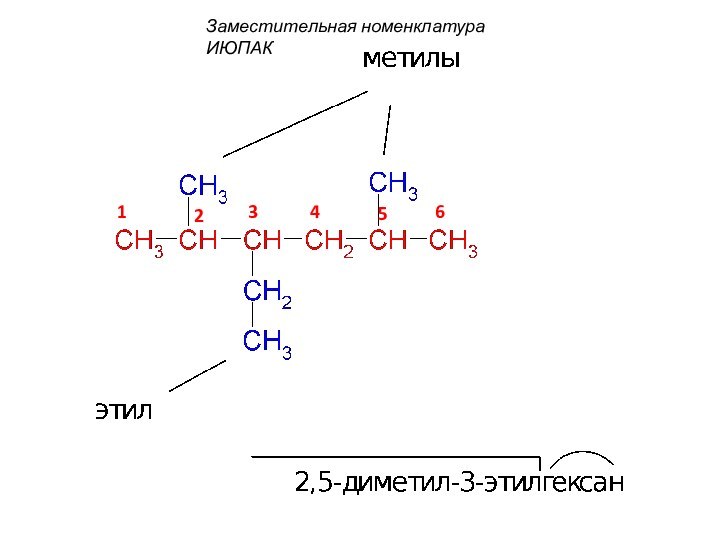
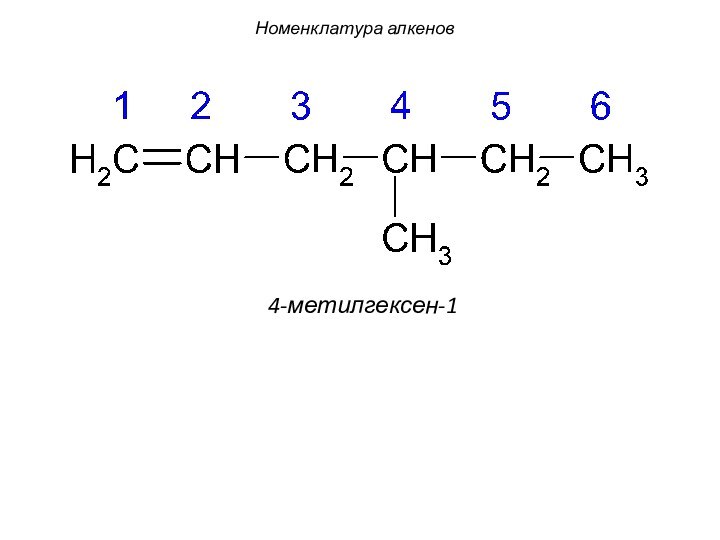
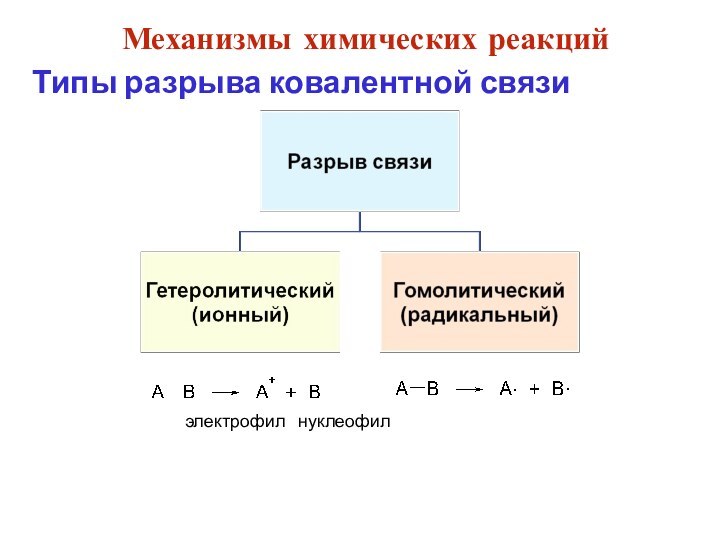
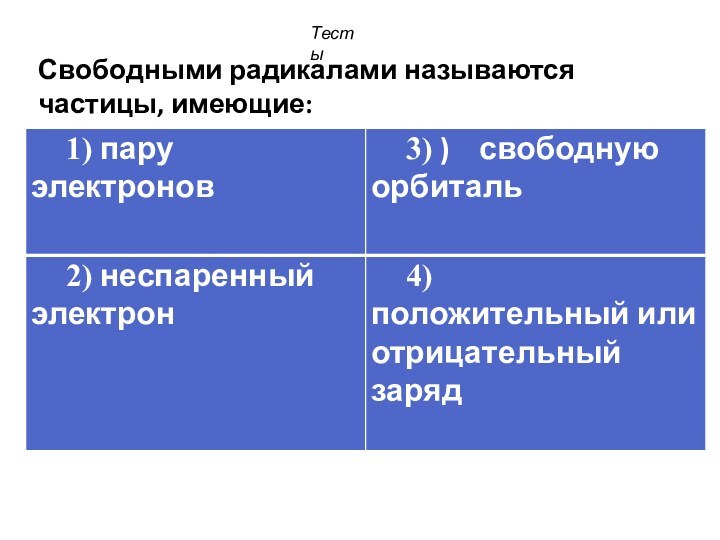
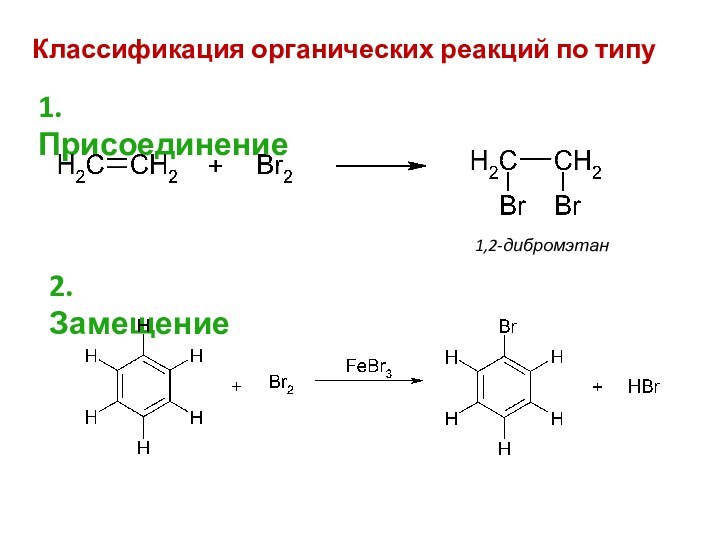
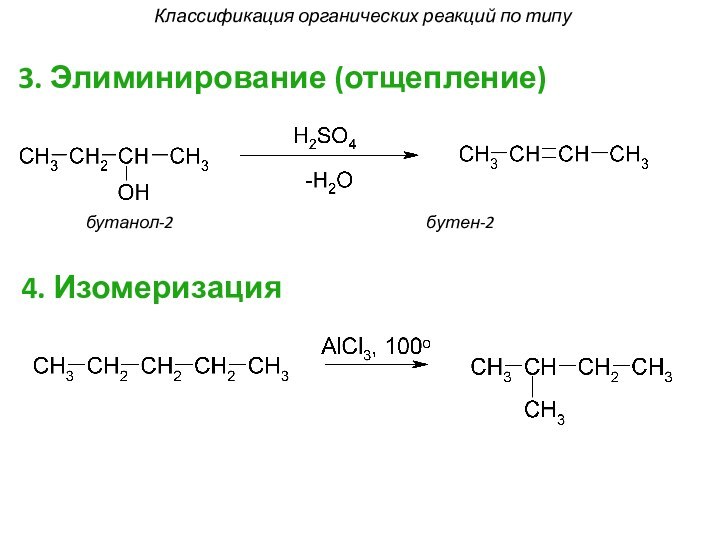
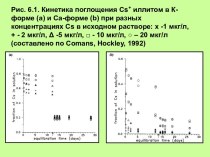
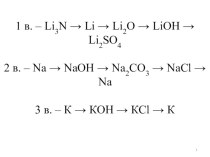
смещением электронной плотности от одних
атомов к другим. При
этом на атомах появляется частичный заряд: δ- или δ+
(дельта минус или дельта плюс).
Третье положение теории А. М. Бутлерова
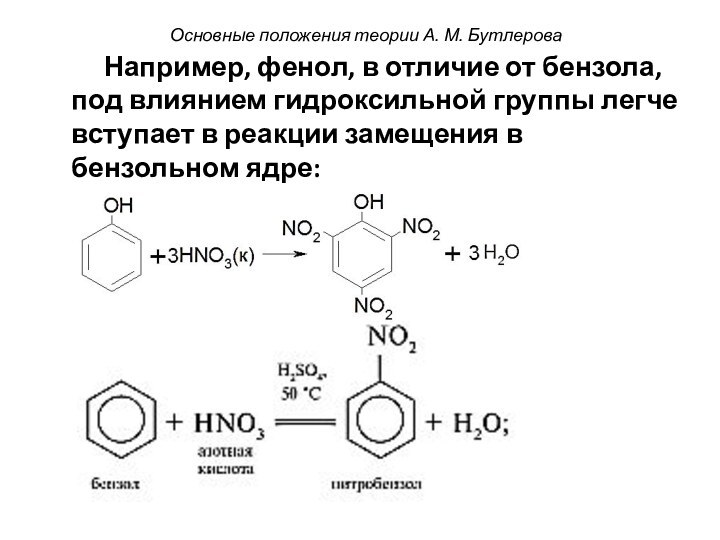
Атомы или группы атомов, входящие в состав молекулы, взаимно влияют друг на друга, что сказывается на реакционной способности молекулы в целом.