- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основания
Содержание
- 2. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними ионов гидроксильных групп.
- 3. Валентность гидроксогруппы – Количество гидроксогрупп определяется валентностью металла, образующего основание. Например:
- 4. Название основанийГидроксид +Название металла в родительном падеже+Валентность римскими цифрами
- 5. Дайте названия гидроксидамNaOHCa(OH)2Fe(OH)2Fe(OH)3Al(OH)3Гидроксид натрияГидроксид железа (II)Гидроксид кальция Гидроксид алюминия Гидроксид железа (III)
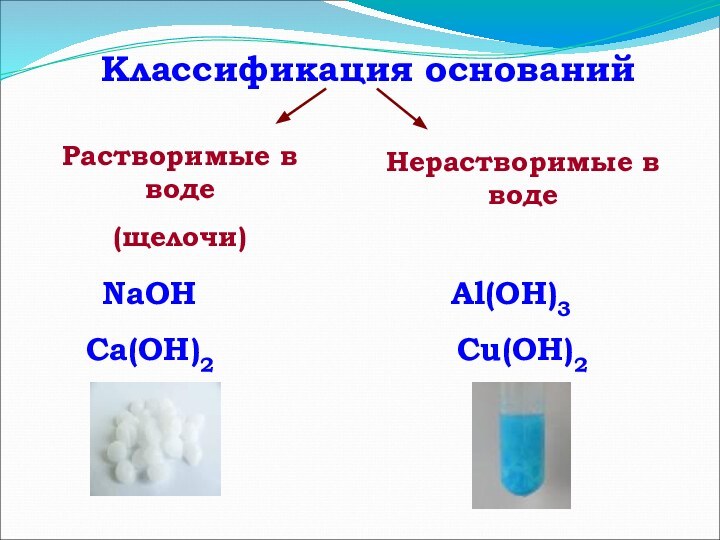
- 6. Классификация основанийРастворимые в воде(щелочи)Нерастворимые в водеNaOHCa(OH)2Al(OH)3Сu(OH)2
- 7. Получение оснований и их свойства
- 8. Взаимодействие натрия с водой
- 9. Взаимодействие основных оксидов с водой
- 10. Действие щелочей на индикаторы
- 11. Индикаторы – от лат. «indication» - указателиNaOHNaOHNaOHЛакмус Метиловый оранжевыйФенолфталеин
- 12. Взаимодействие с индикаторамиПомни! Нерастворимые основания не меняют окраску индикаторов.
- 13. Щёлочь + оксид неметалла → соль +
- 14. Щелочь + соль → новое основание
- 15. Получение нерастворимых оснований
- 16. Химические свойства нерастворимых оснований
- 17. Нерастворимое основание →оксид металла +
- 18. Скачать презентацию
- 19. Похожие презентации
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними ионов гидроксильных групп.
















Слайд 2
Основания
– это сложные вещества, состоящие из ионов
металлов и связанных с ними ионов гидроксильных групп.
Слайд 3
Валентность гидроксогруппы –
Количество гидроксогрупп определяется валентностью металла,
образующего основание.
Например:
Слайд 4
Название оснований
Гидроксид
+
Название металла в родительном падеже
+
Валентность римскими
цифрами
Слайд 5
Дайте названия гидроксидам
NaOH
Ca(OH)2
Fe(OH)2
Fe(OH)3
Al(OH)3
Гидроксид натрия
Гидроксид железа (II)
Гидроксид кальция
Гидроксид
алюминия
Гидроксид железа (III)
Слайд 6
Классификация оснований
Растворимые в воде
(щелочи)
Нерастворимые в воде
NaOH
Ca(OH)2
Al(OH)3
Сu(OH)2
Слайд 11
Индикаторы –
от лат. «indication» - указатели
NaOH
NaOH
NaOH
Лакмус
Метиловый
оранжевый
Фенолфталеин
Слайд 13 Щёлочь + оксид неметалла → соль + вода
( реакция обмена)
УСЛОВИЕ:
оксиду неметалла должна соответствовать определенная кислота например: N2+5O5 → H N+5O3
S+6O3 → H2 S+6O4
2KOH + N2O5 → 2KNO3 + H2O
2LiOH + SO3 → Li2SO4 + H2O
Слайд 14 Щелочь + соль → новое основание +
новая соль
( реакция обмена)
УСЛОВИЯ:образуется осадок;
выделяется газ.
6KOH+Fe2(SO4)3→2Fe(OH)3↓+
3K2SO4
2-
2-
Слайд 17 Нерастворимое основание →оксид металла + вода
Mg(OH)2 ↓→ MgO + H2O
2Fe(OH)3 ↓→ Fe2O3 + 3H2O
Данный тип реакции нехарактерен для растворимых оснований





























