- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Неметаллы. Кислородные соединения неметаллов
Содержание
- 2. КислотыВысшим оксидам неметаллов соответствуют следующие кислоты
- 3. Высшим оксидам неметаллов соответствуют следующие кислоты
- 4. КислотыКислородосодержащие кислоты являются гидроксидами кислотных оксидов.По основностиодноосновныедвухосновныетрехосновныечетырехосновные
- 5. КислотыПо силесильныесредней силыслабые
- 6. КислотыПо окислительной способностиКислоты-окислителиКислоты-неокислители
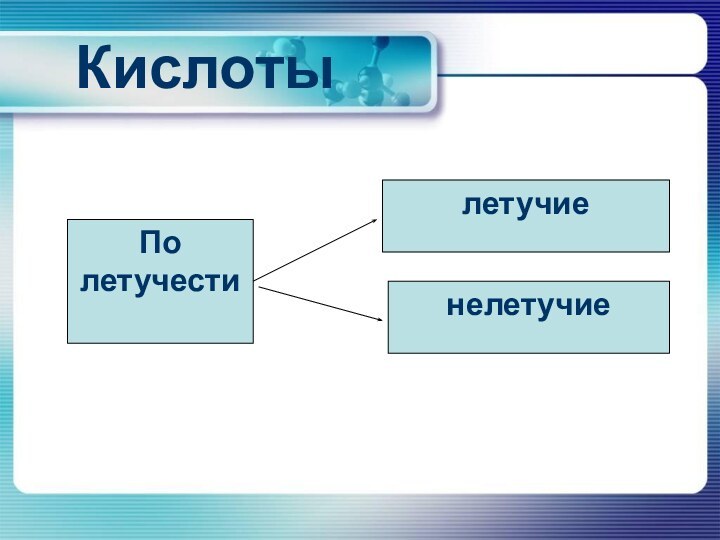
- 7. КислотыПо летучестилетучиенелетучие
- 8. КислотыПо устойчивости (прочности)устойчивыенеустойчивые
- 9. КислотыФизические свойства По агрегатному состоянию:большинство кислот жидкостинекоторые
- 10. КислотыПочти все кислоты хорошо растворимы в воде
- 11. КислотыОбщие химические свойства кислот: Попробуйте вспомнить и перечислите
- 12. КислотыКислоты-неокислители взаимодействуют с металлами стоящими в ряду
- 13. КислотыКислоты-окислители (H2SO4, HNO3) в водном растворе вступают
- 14. КислотыПочти все кислоты разлагаются при нагревании.Если при
- 15. КислотыЕсли разложение ОВР, то продукты разнообразны: 4HNO3 =
- 16. КислотыС неметаллами реагируют только кислоты обладающими сильными
- 17. КислотыS + HNO3 (разб) =S + HNO3
- 18. КислотыКислоты-окислители могут реагировать с безкислородными кислотами, обладающими
- 19. Скачать презентацию
- 20. Похожие презентации
КислотыВысшим оксидам неметаллов соответствуют следующие кислоты


















Слайд 4
Кислоты
Кислородосодержащие кислоты являются гидроксидами кислотных оксидов.
По основности
одноосновные
двухосновные
трехосновные
четырехосновные
Слайд 9
Кислоты
Физические свойства
По агрегатному состоянию:
большинство кислот жидкости
некоторые растворы
газов в воде (H2CO3, H2SO3)
HIO4)
Слайд 10
Кислоты
Почти все кислоты хорошо растворимы в воде кроме
H2SiO3
При растворении в воде метакислоты переходят в ортокислоты
HPO3 +
H2O =
Слайд 11
Кислоты
Общие химические свойства кислот:
Попробуйте вспомнить и перечислите все
химические свойства. Приведите пример на каждое свойство (молекулярные и
ионные уравнения).
Слайд 12
Кислоты
Кислоты-неокислители взаимодействуют с металлами стоящими в ряду напряжений
до водорода и образуется водород и соль металла с
низшей С.О.
Слайд 13
Кислоты
Кислоты-окислители (H2SO4, HNO3) в водном растворе вступают в
реакции практически со всеми металлами (кр.Au, Pt ). В
качестве окислителя выступает анион кислотного остатка. В результате этих реакций образуются соль металла в высшей С.О., вода и продукт восстановления кислоты.
Слайд 14
Кислоты
Почти все кислоты разлагаются при нагревании.
Если при разложении
не происходит ОВР, то продуктами разложения являются вода и
кислотный оксид(или кислота с меньшим содержанием H2O)
Слайд 15
Кислоты
Если разложение ОВР, то продукты разнообразны:
4HNO3 = 4NO2
+ O2 + 2H2O
3HNO2 = HNO3 + 2NO +
H2O3HClO = 2HCl + HClO3
4H3PO3 = 3H3PO4 + PH3
Слайд 16
Кислоты
С неметаллами реагируют только кислоты обладающими сильными окислительными
свойствами.
При их взаимодействии неметалл окисляется до соответствующей кислоты(или
ее ангидрида), а кислота восстанавливается до газообразного оксида.H2SO4 (конц)- SO2 HNO3(конц)- NO2
HNO3(разб)- NO
Слайд 17
Кислоты
S + HNO3 (разб) =
S + HNO3 (конц)
=
C + HNO3 (конц) =
S + H2SO4 (конц) =
P
+ HNO3 (конц) =P + HNO3 (разб) =
Слайд 18
Кислоты
Кислоты-окислители могут реагировать с безкислородными кислотами, обладающими восстановительными
свойствами
H2SO4 (конц) + 2HBr = Br2 + SO2 +
2H2OH2SO4 (конц) + 8HI = 4I2 + H2S + 4H2O
H2SO4 (конц) + H2S = S + SO2 + 2H2O
8HNO3 (конц) + H2S = H2SO4 + 8NO2 + H2O