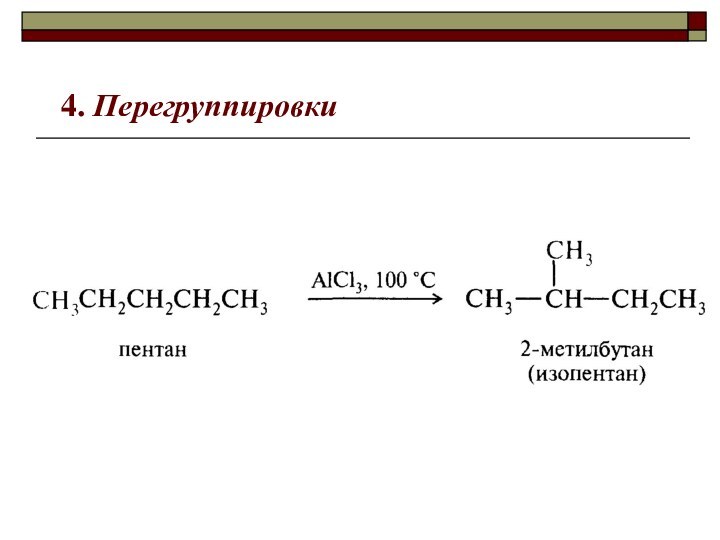
реакции делят на
1)
реакции замещения , S , (substitution замещение)CH4 + Cl2 CH3Cl + HCl вытеснен один атом;
һν
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


















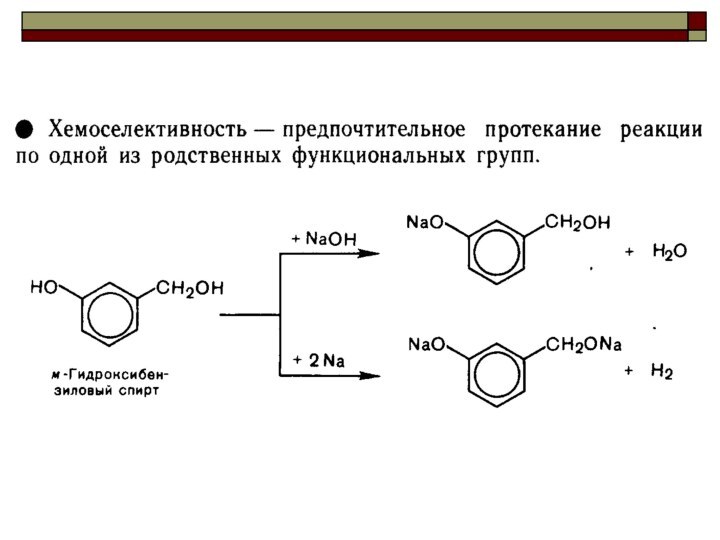
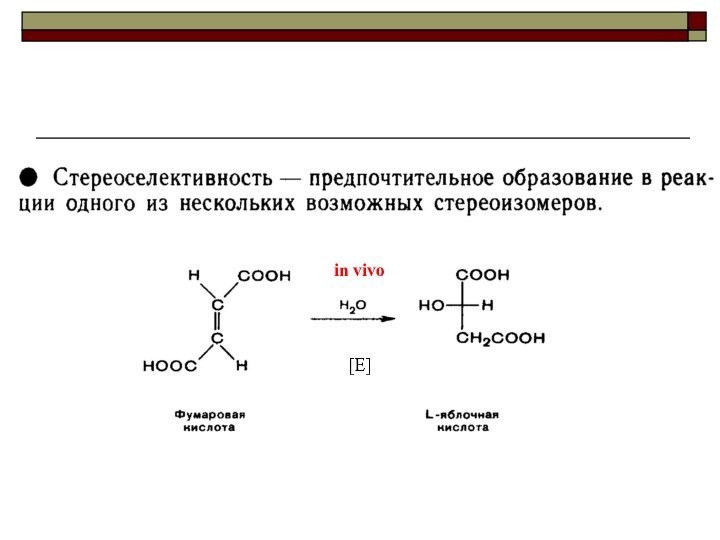

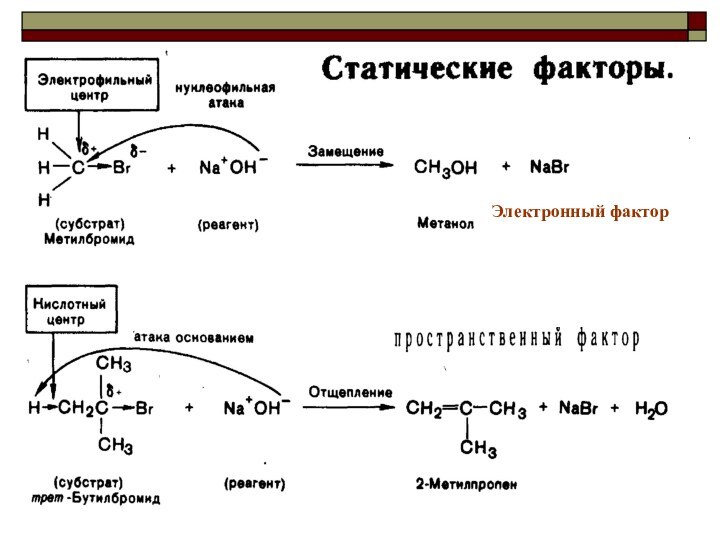

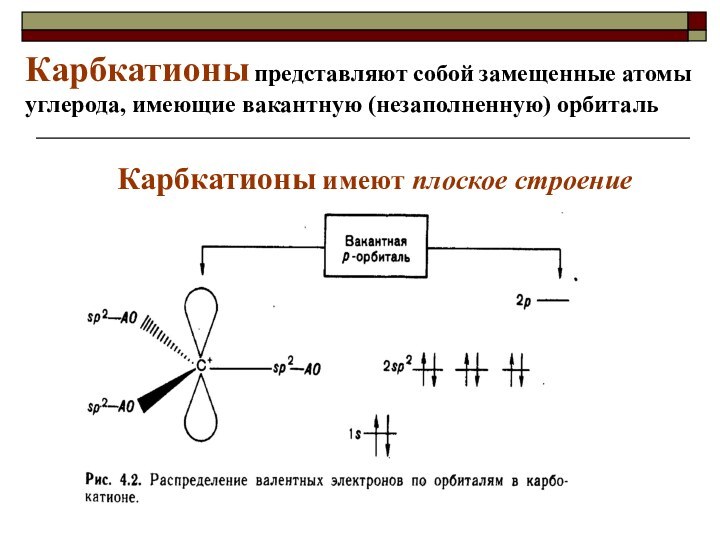










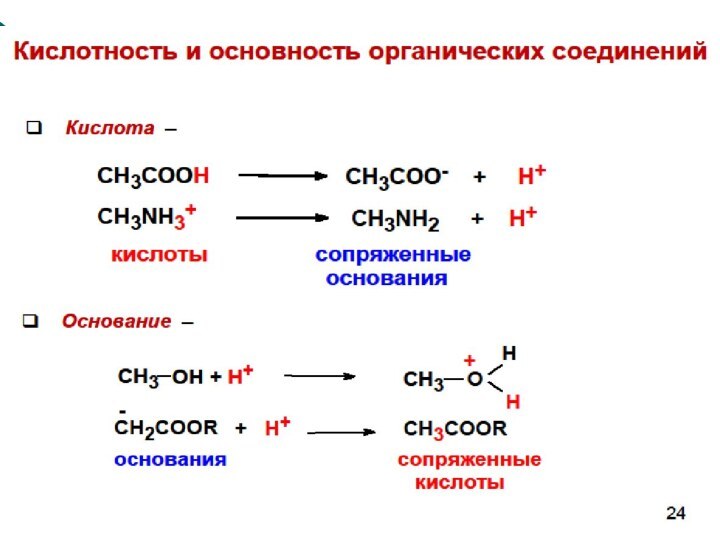









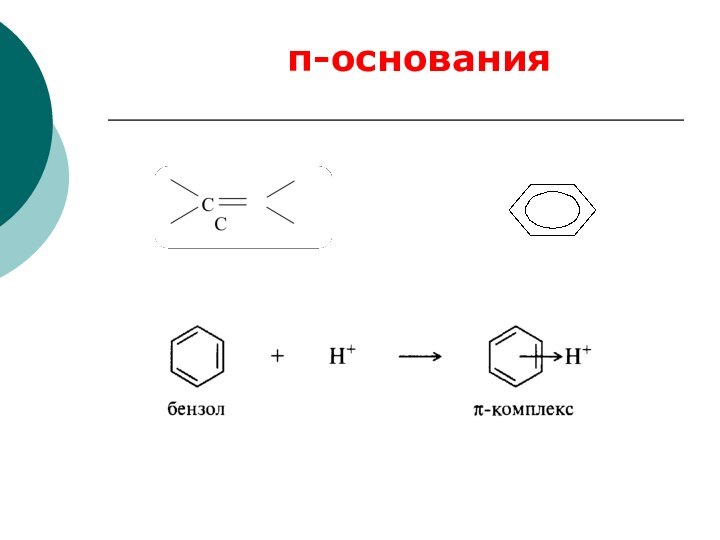
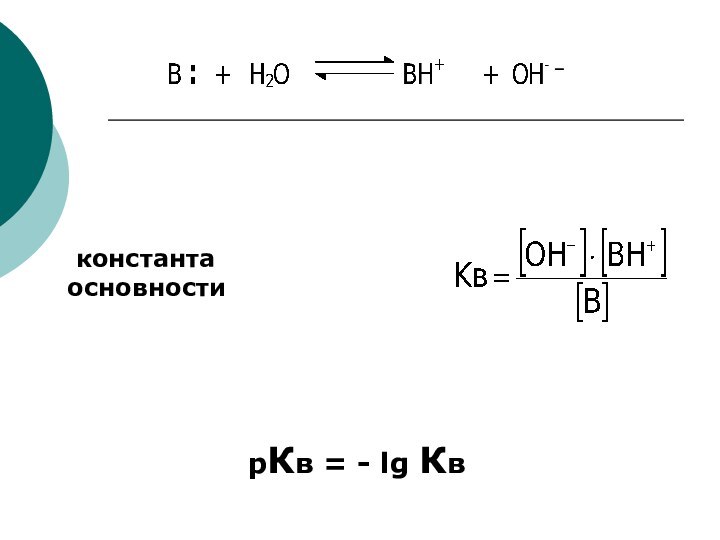
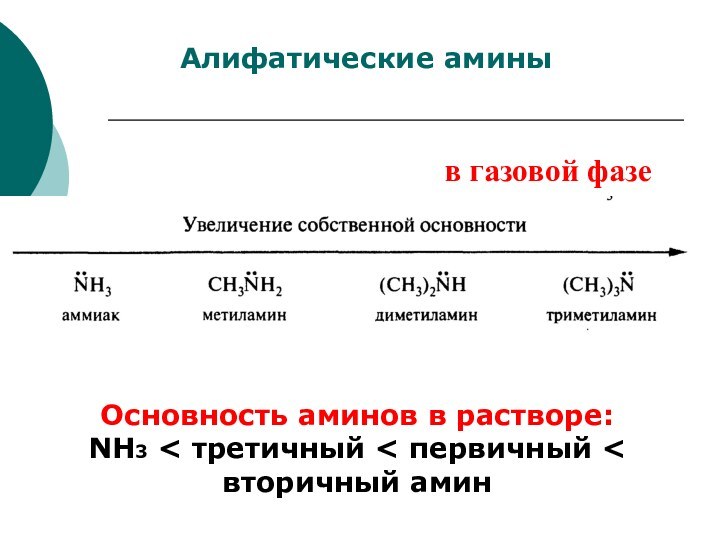
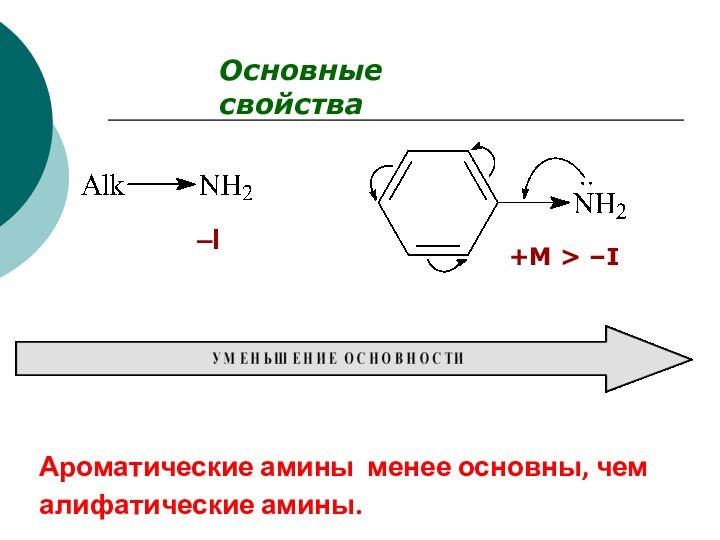
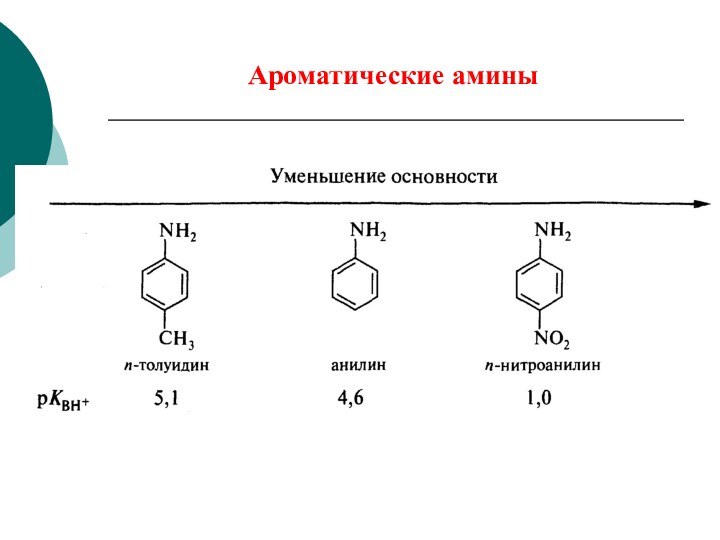
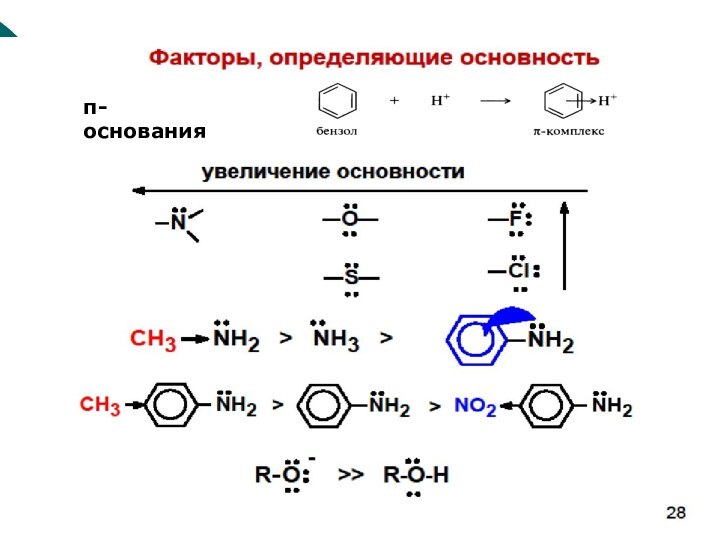

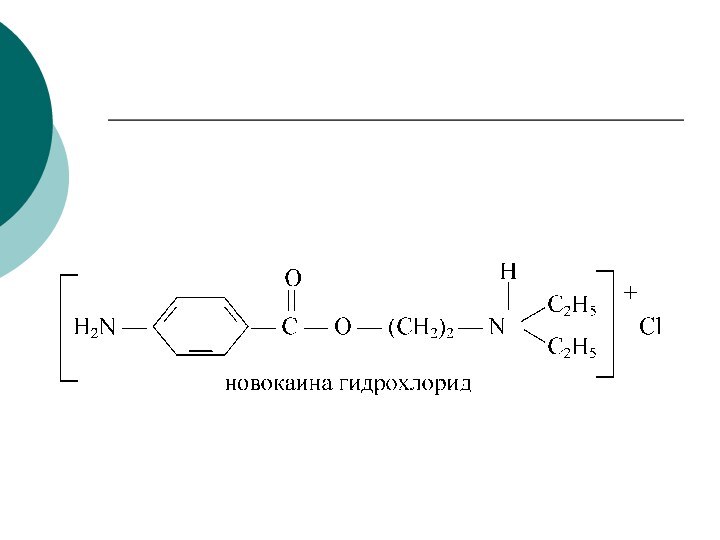

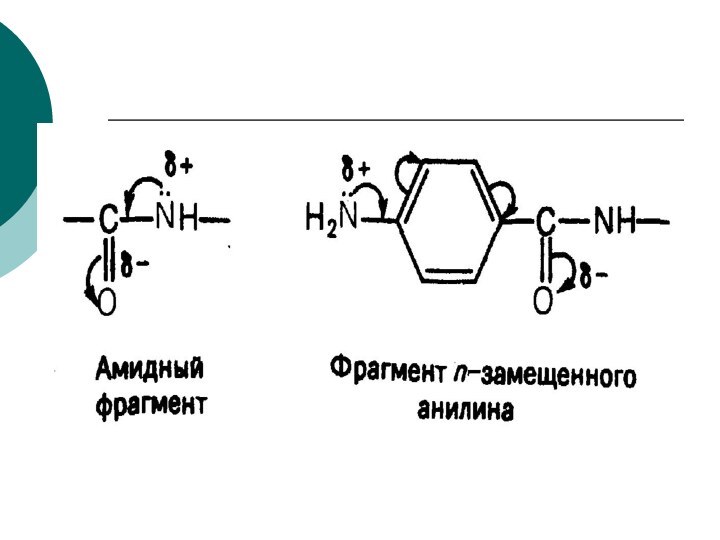
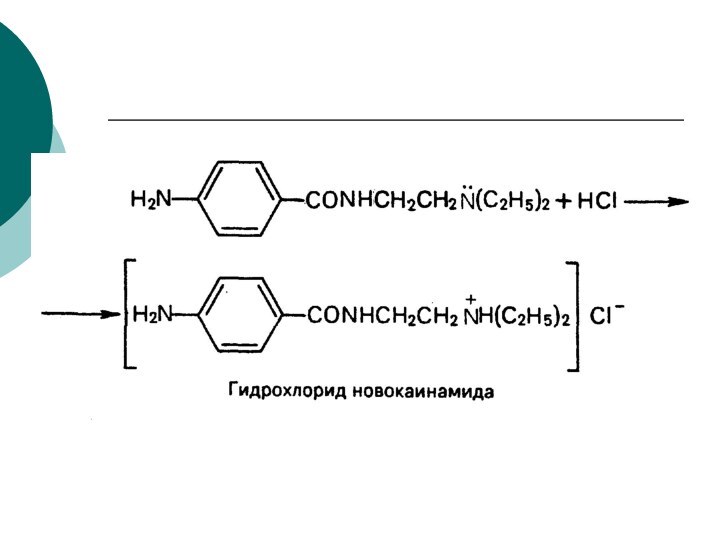
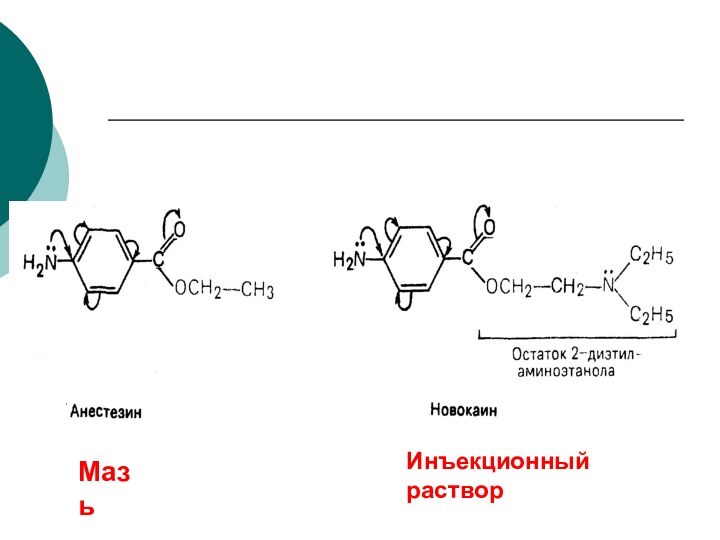


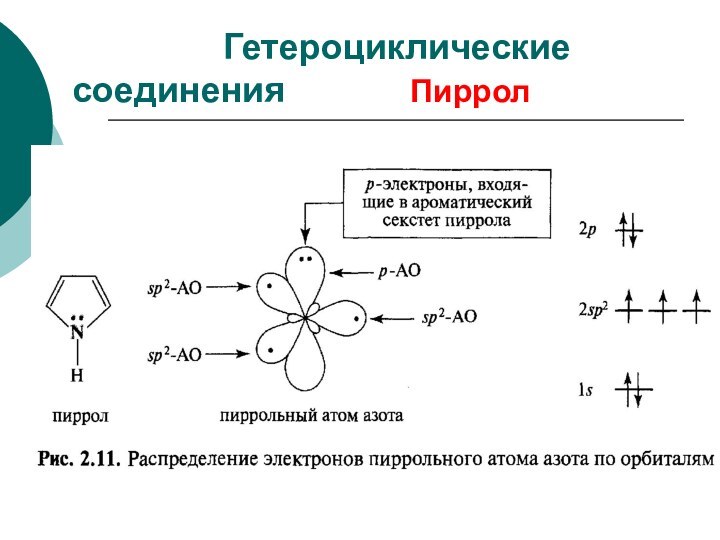




CH4 + Cl2 CH3Cl + HCl вытеснен один атом;
һν
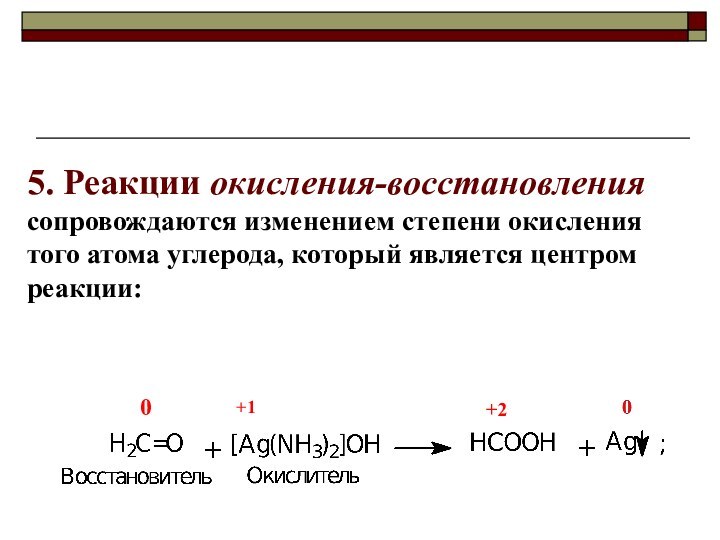
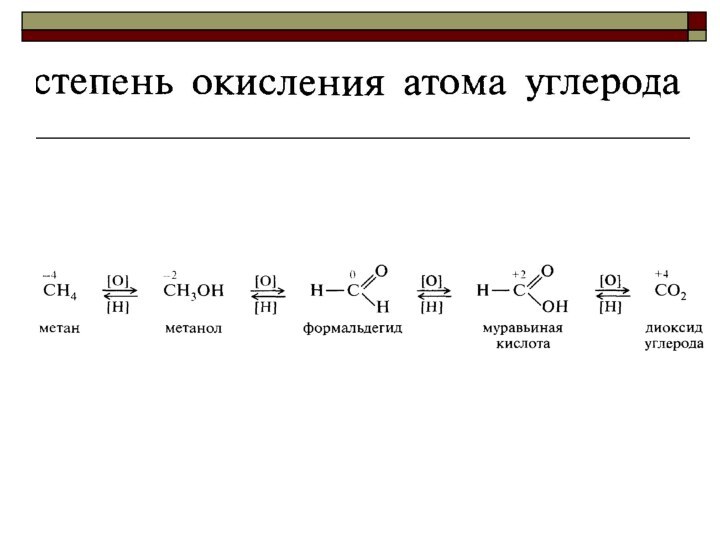
Oкислитель всегда принимает (отнимает!) электроны,
а восстановитель - отдаёт их!
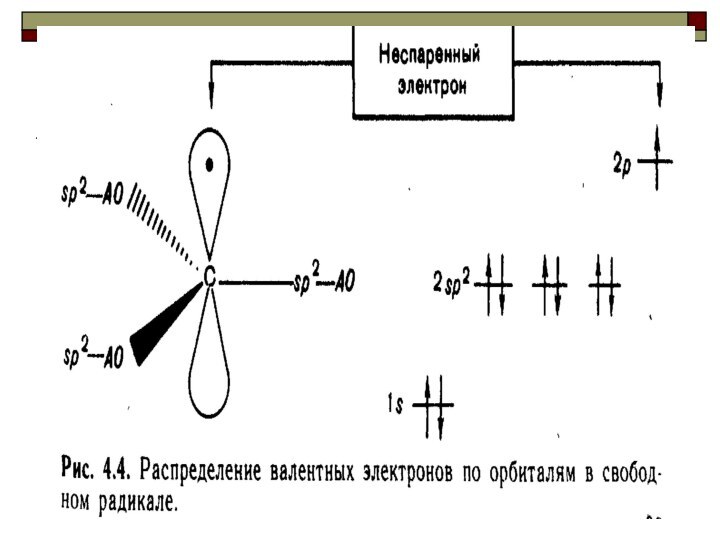
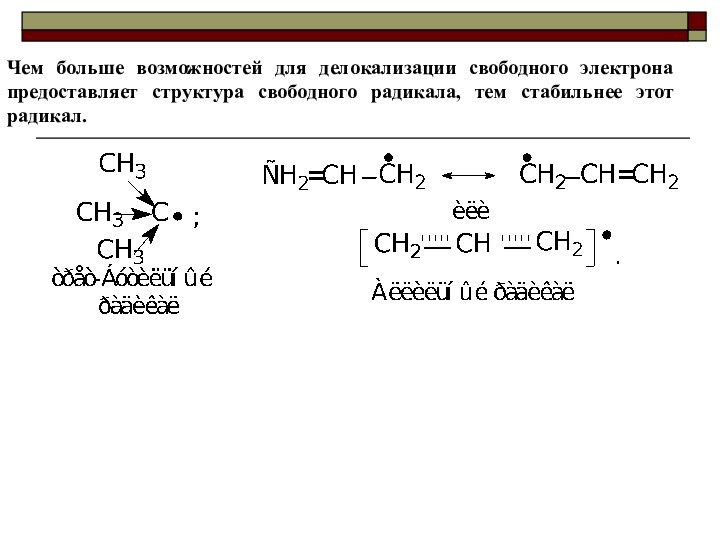
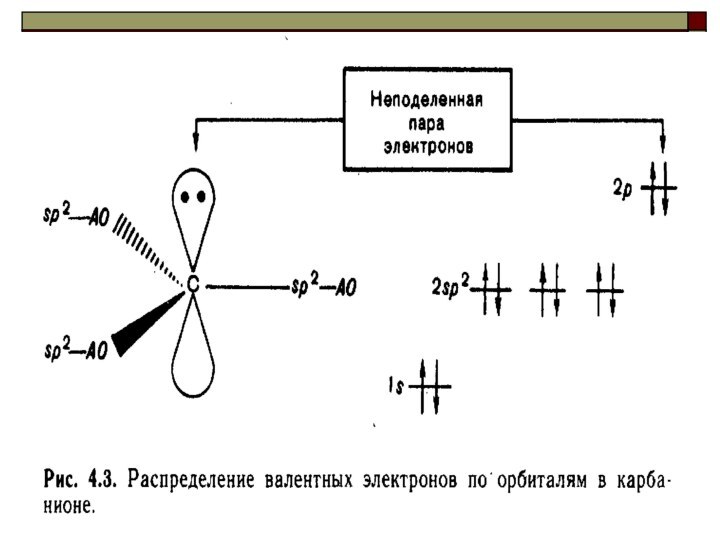
Ряд увеличения стабильности свободных радикалов:
(нужны электронодонорные заместители)
(нужны электроноакцепторные заместители)
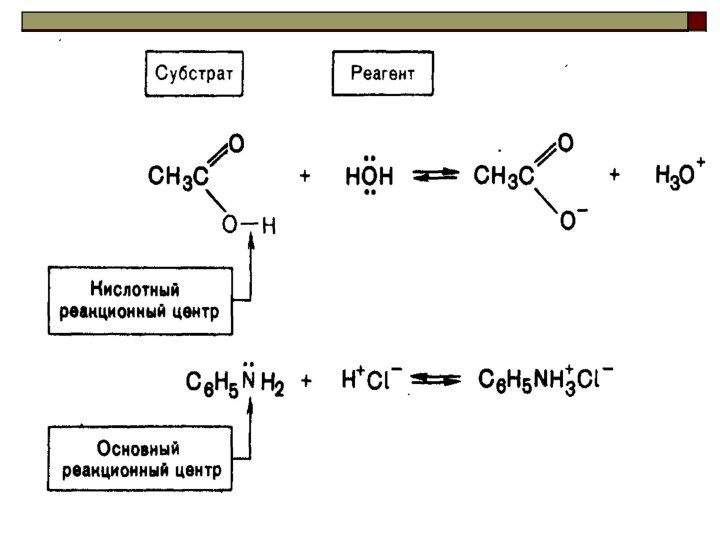
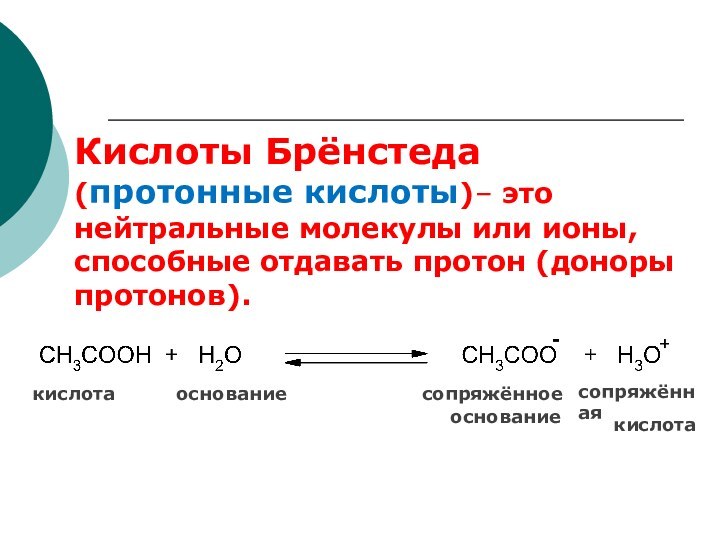
сопряжённая
кислота основание сопряжённое
основание
кислота
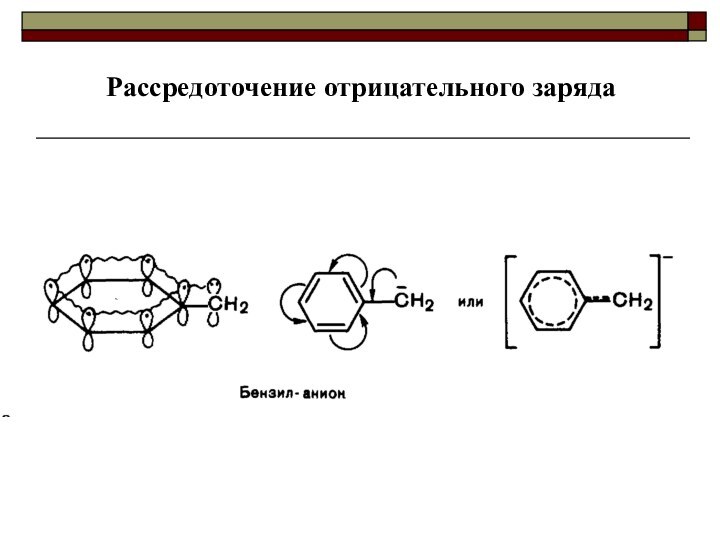
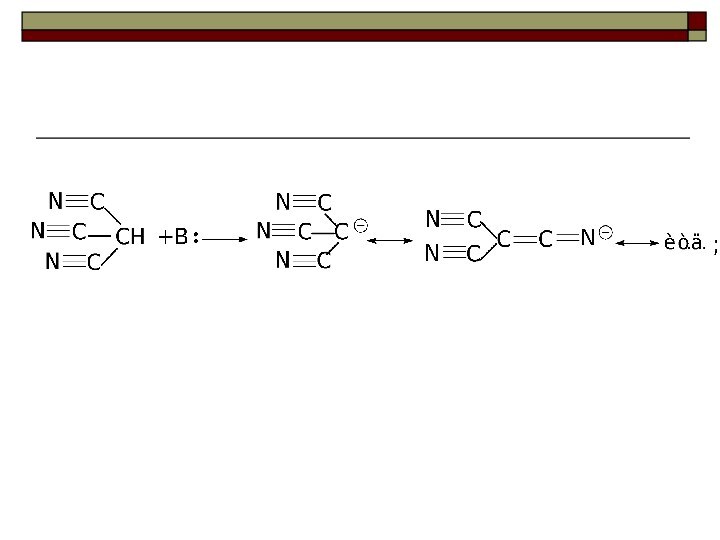
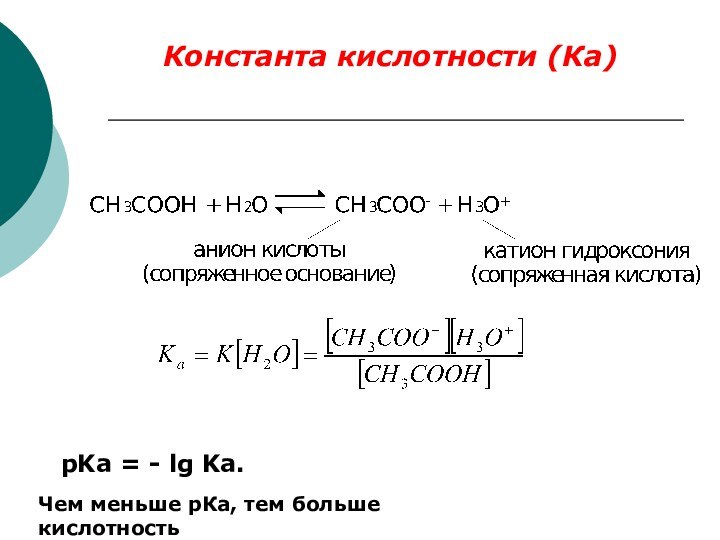
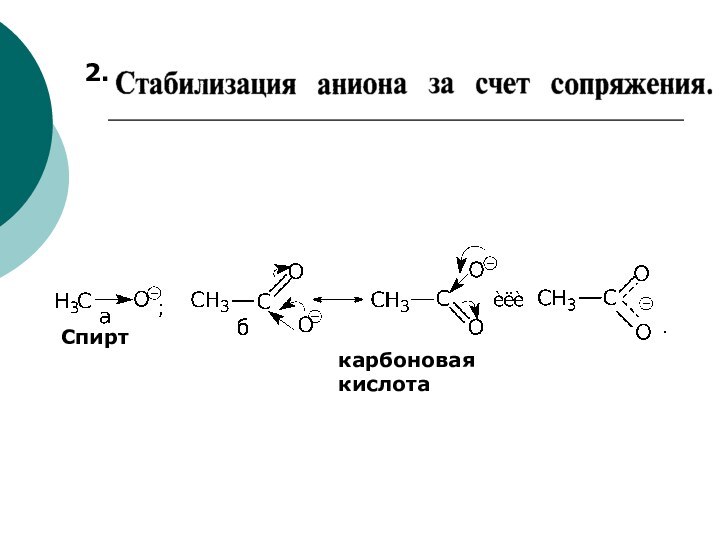
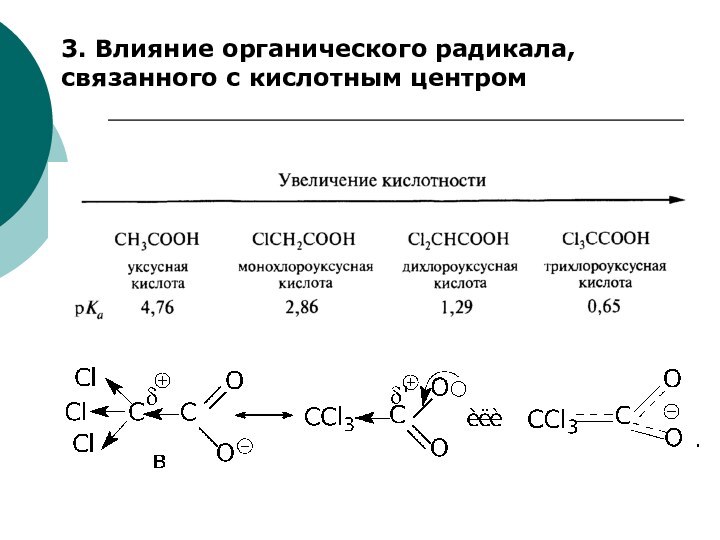
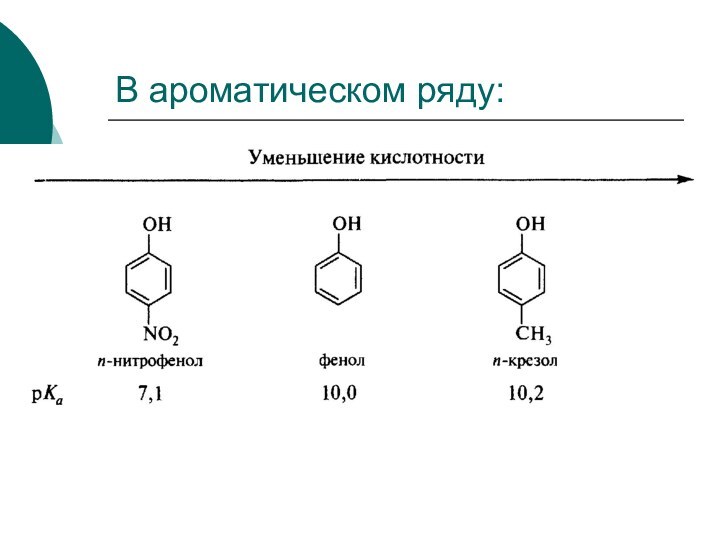
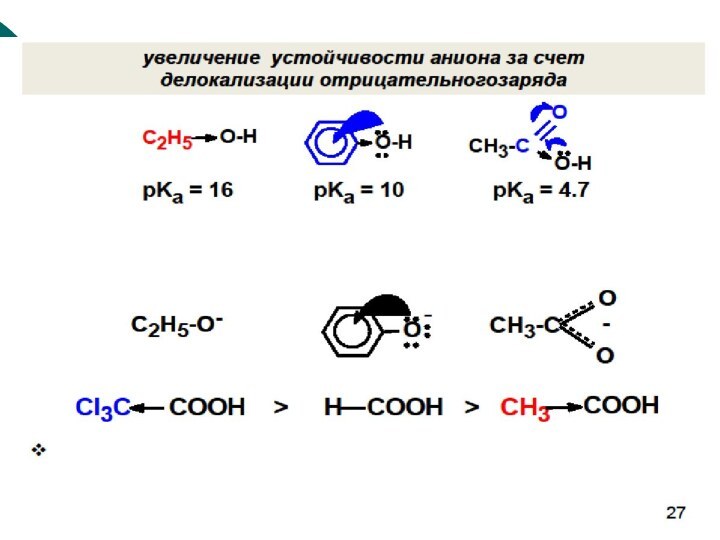
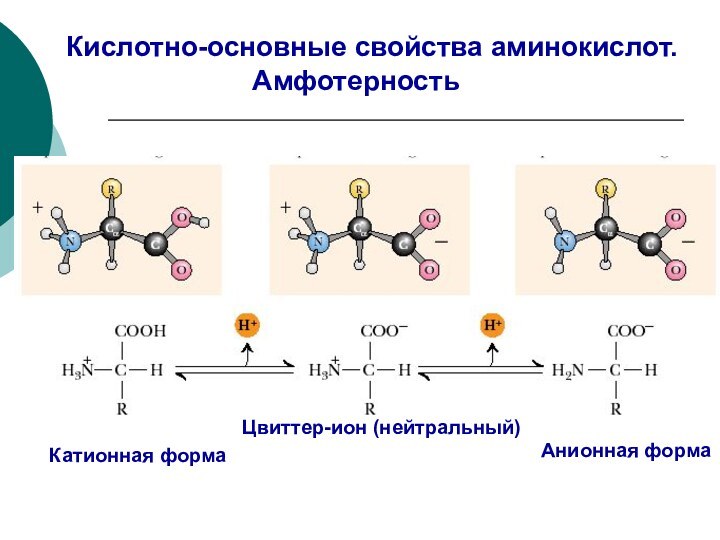
Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона.
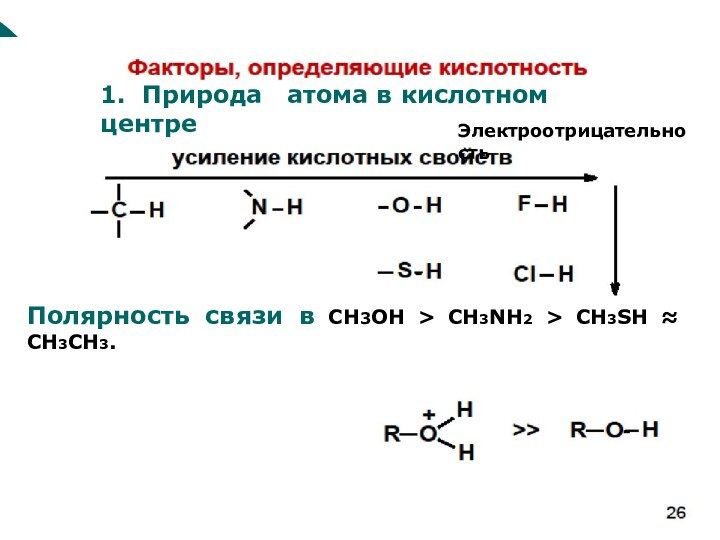
(Поляризуемость)
катион
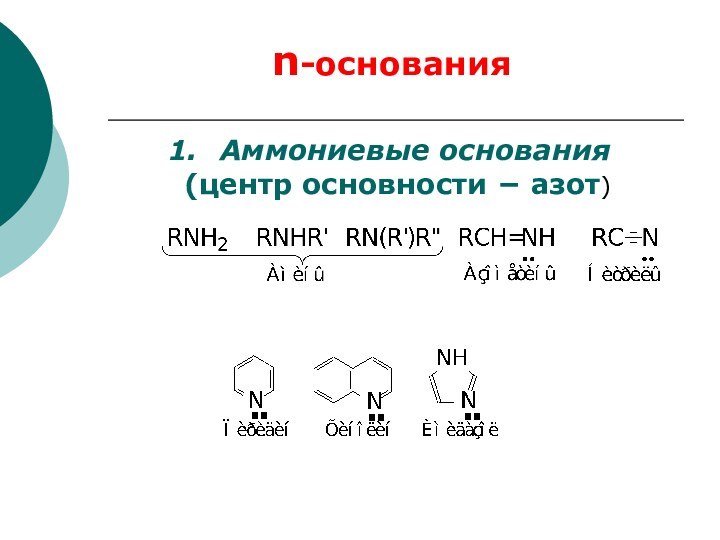
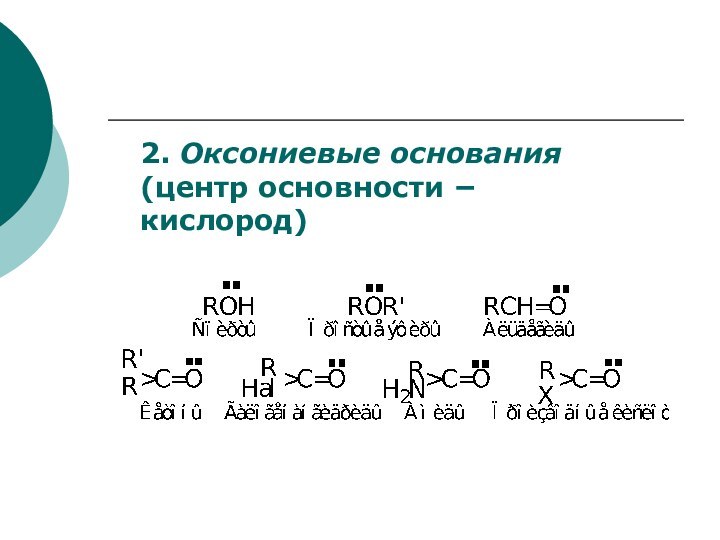
основание
_