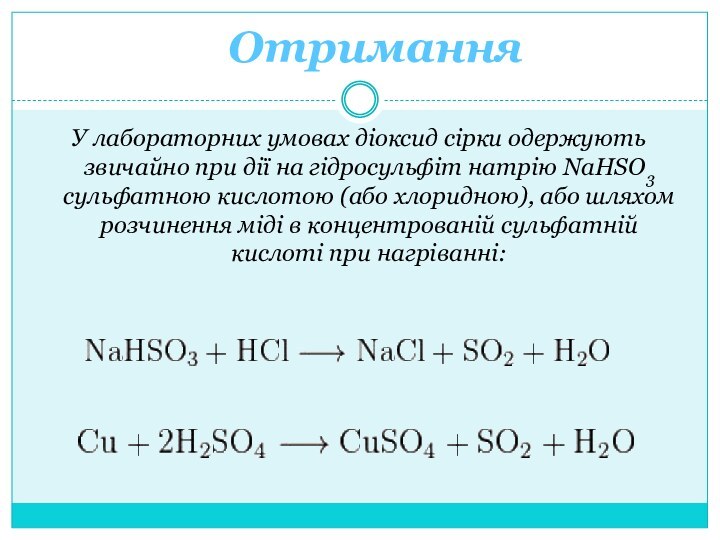
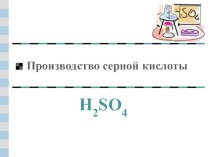
володіє злегка кислим смаком. Формується при з'єднанні двох елементів:
вуглецю і кисню. Він утворюється в процесі спалювання вугілля або вуглеводневих сполук, при ферментації рідин, а також як продукт дихання людей і тварин.Вуглекислий газ добре розчиняється у воді, особливо під тиском. Навіть при невисокому тиску і кімнатній температурі перетворюється на рідину. Зріджений вуглекислий газ зберігають у стальних балонах.
ВУГЛЕКИСЛИЙ ГАЗ ТА ЙОГО ВЛАСТИВОСТІ