отменно
элементы галогены.
А по-русски - солероды,Все – от фтора и до йода.
Даже неустойчивый астат
Быть в семействе этом рад.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



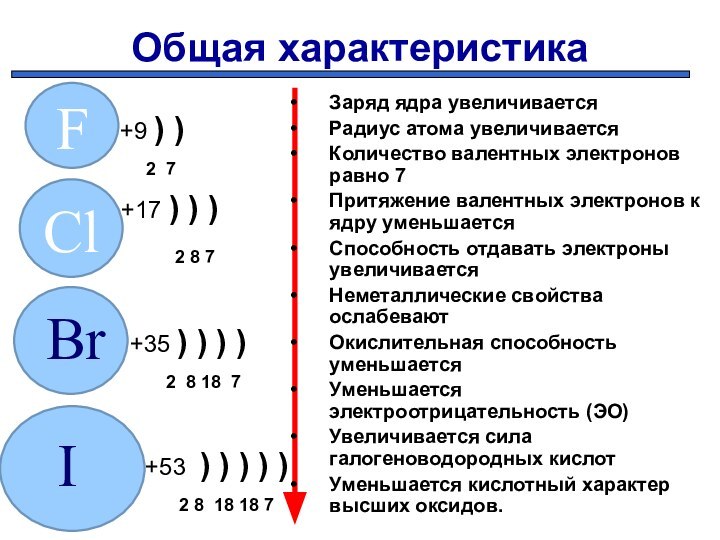























Заряд ядра увеличивается
Радиус атома увеличивается
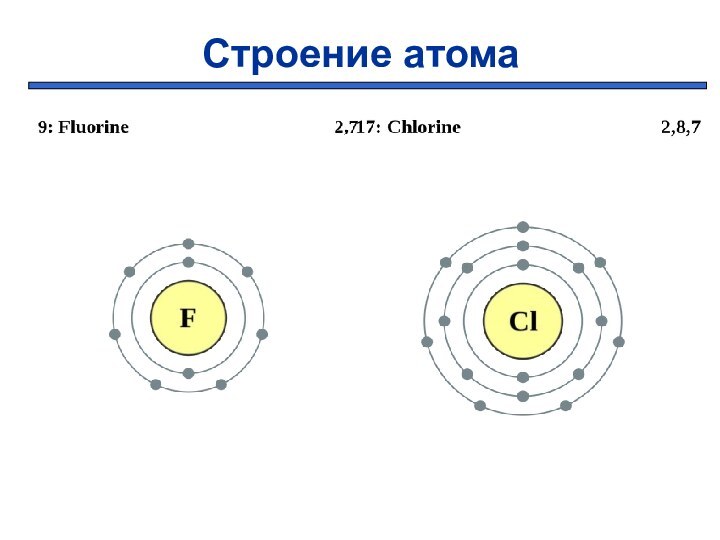
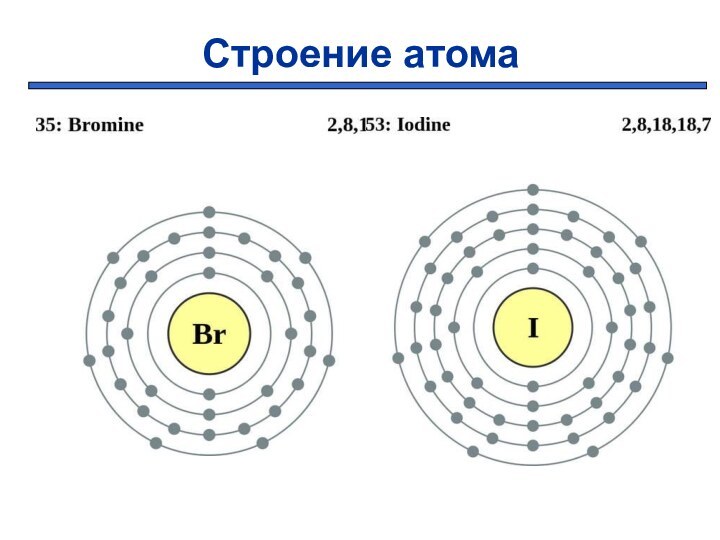
Количество валентных электронов равно 7
Притяжение валентных электронов к ядру уменьшается
Способность отдавать электроны увеличивается
Неметаллические свойства ослабевают
Окислительная способность уменьшается
Уменьшается электроотрицательность (ЭО)
Увеличивается сила галогеноводородных кислот
Уменьшается кислотный характер высших оксидов.
История открытия фтора
Анри Муассан
(1852 – 1907 г.)
2HF→H2↑ + F2↑
История открытия хлора
Карл Вильгельм Шееле
(1742 – 1786 г.)
MnO2+ 4HCl → Cl2+ MnCl2 + 2H2O
История открытия брома
Антуан Жером Балар
(1802 – 1876 г.)
2NaBr + Cl2 → 2NaCl + Br2
История открытия йода
Бернар Куртуа (1777 – 1838 г. )
2 NaI + 2 H2SO4 = I2 + SO2 + Na2 SO4 + 2 H2 O
История открытия астата
20983Bi + 42He → 21185At + 2 10n
Эрст Сегре
(1914 – 1985 г.)
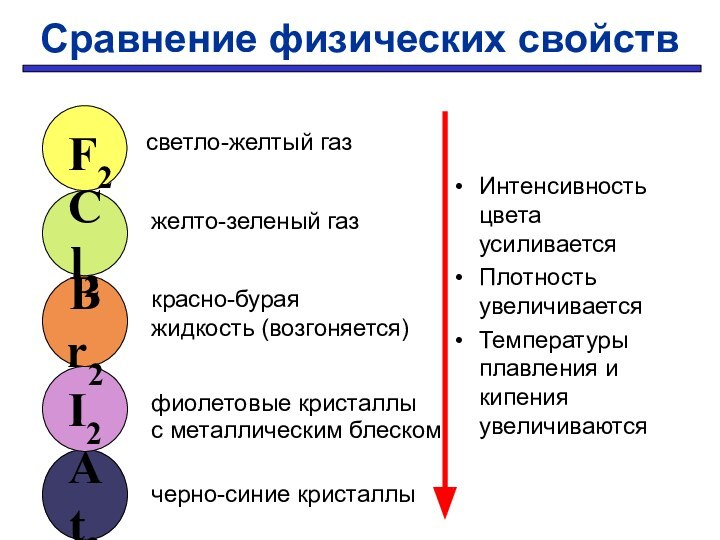
черно-синие кристаллы
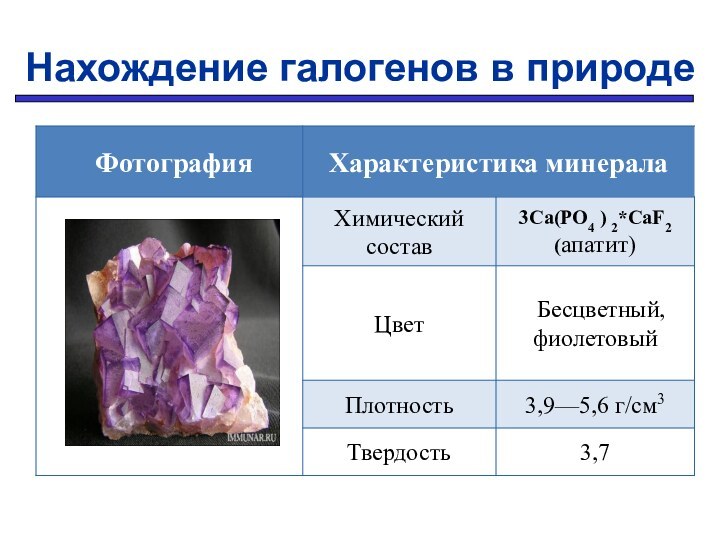
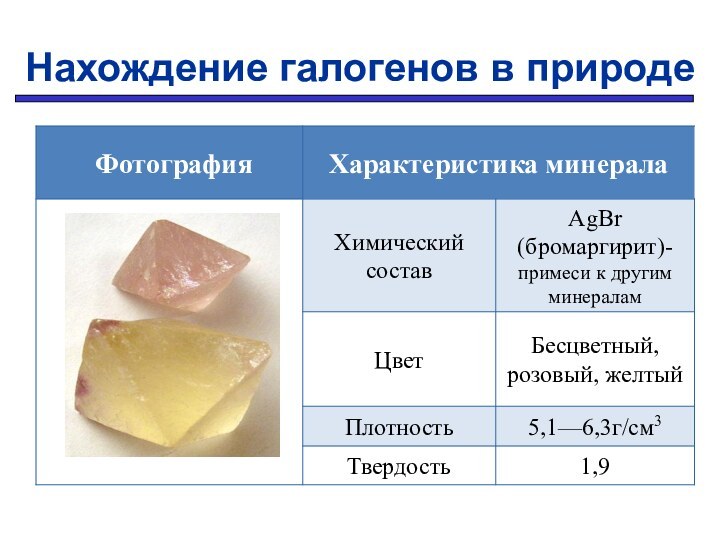
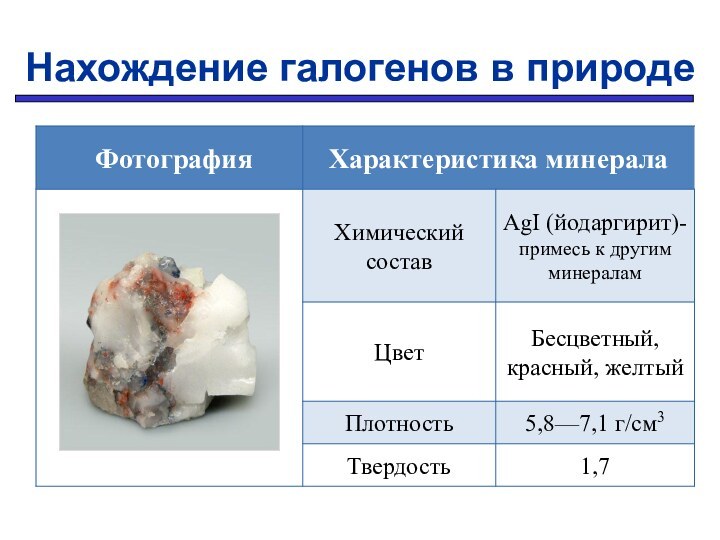
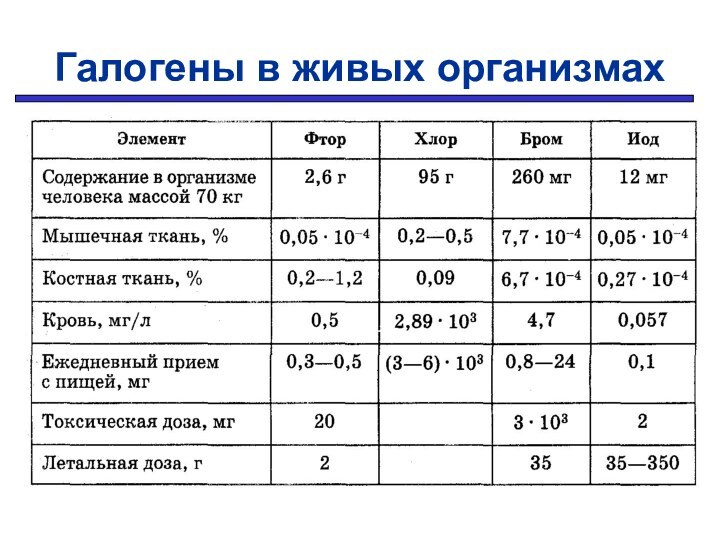
Химические свойства галогенов
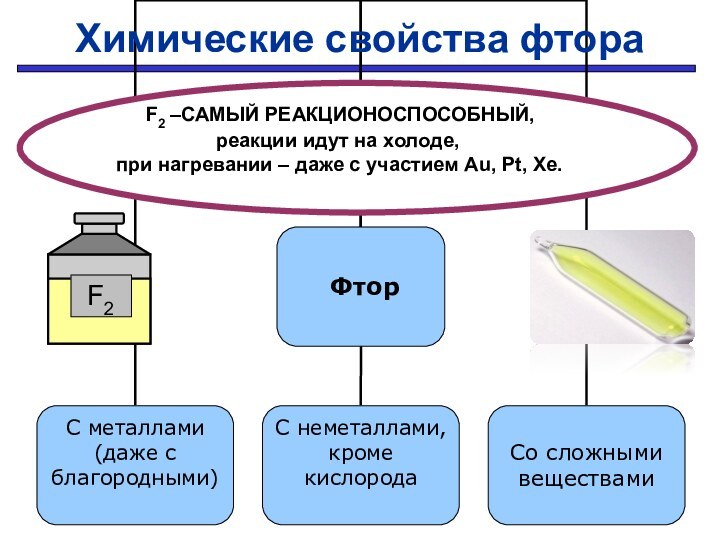
Химические свойства фтора
Химические свойства фтора
Фтор вытесняет любой галоген из соли
Вода горит во фторе фиолетовым пламенем
F2
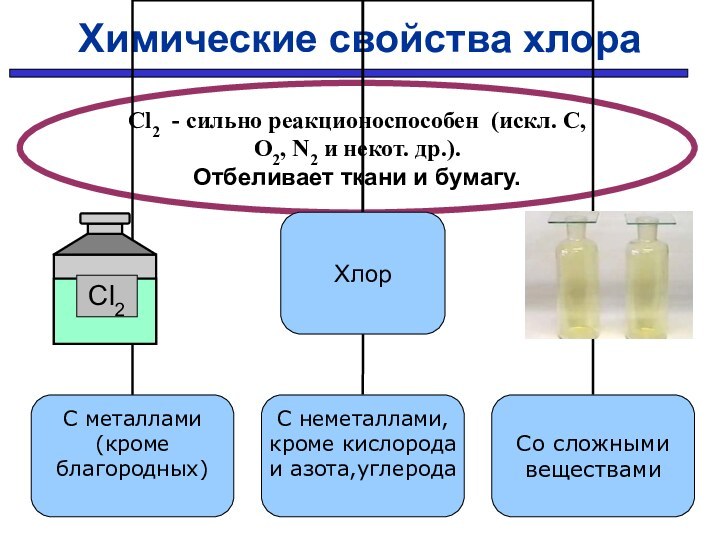
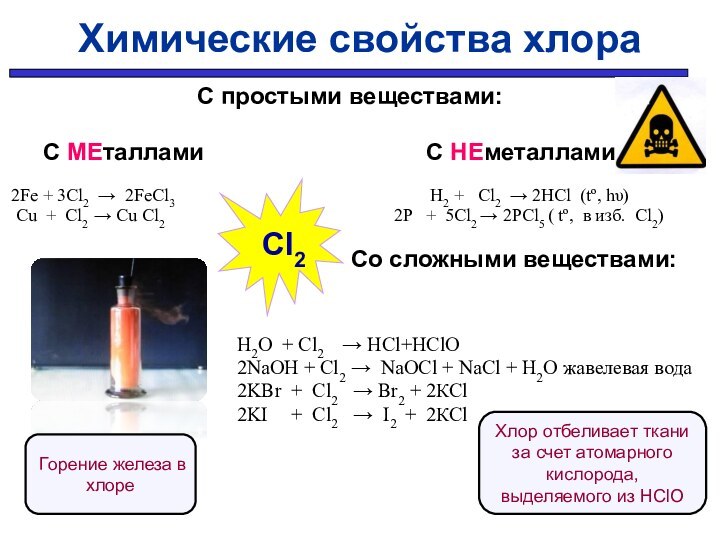
Химические свойства хлора
Горение железа в хлоре
Cl2
Хлор отбеливает ткани за счет атомарного кислорода, выделяемого из НClO
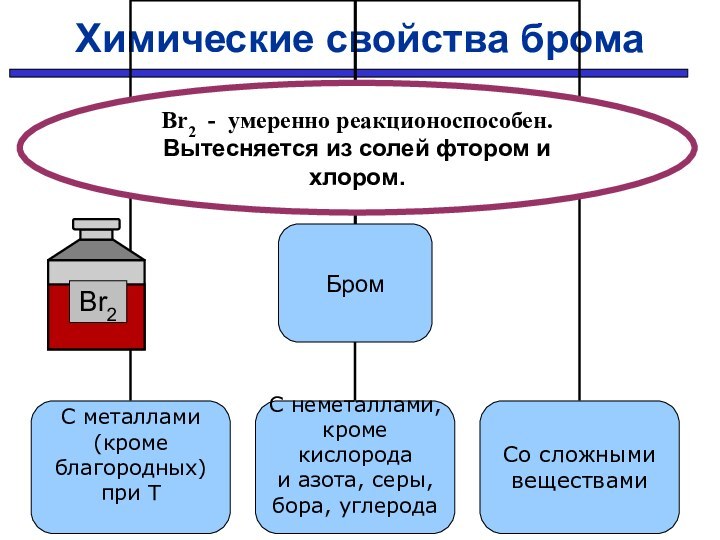
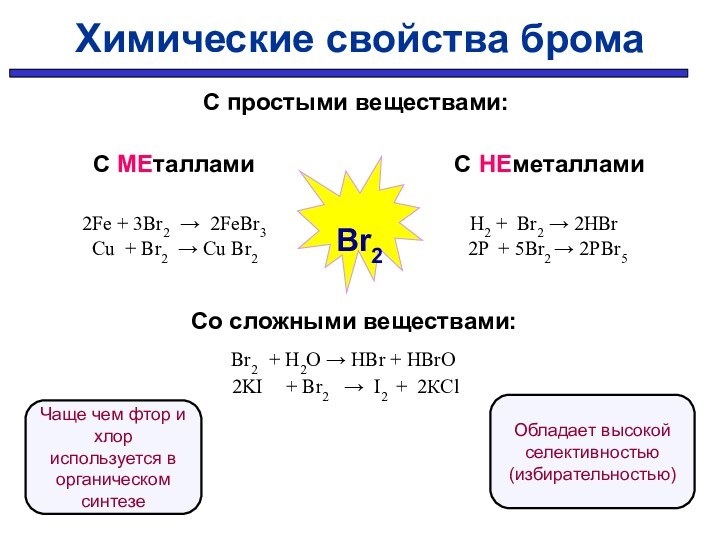
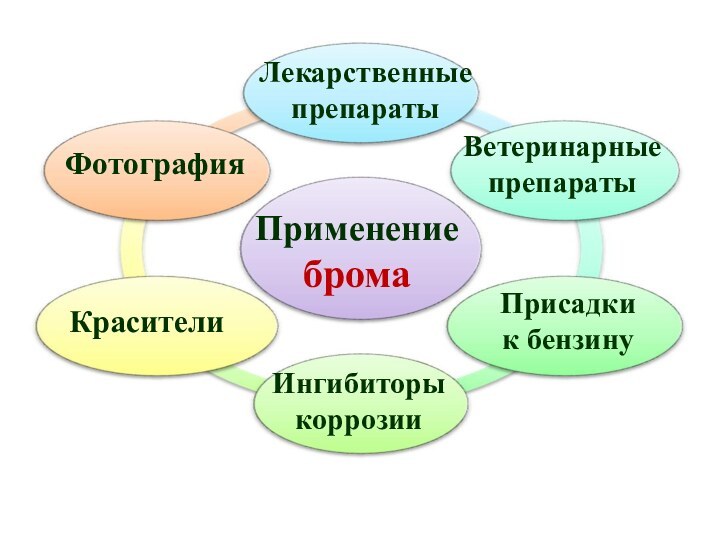
Химические свойства брома
Чаще чем фтор и хлор используется в органическом синтезе
Обладает высокой селективностью (избирательностью)
Br2
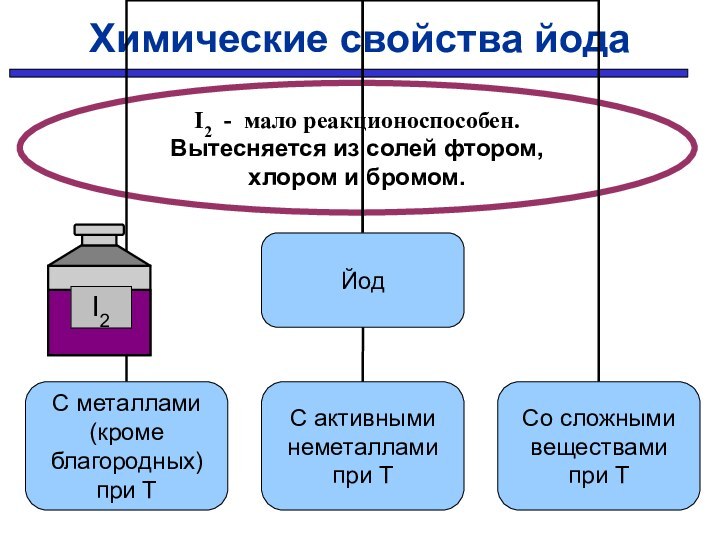
Химические свойства йода
I2
Окисляется конц. серной и азотной кислотами
AgBr + MeNO3
AgI + MeNO3
AgF + MeNO3
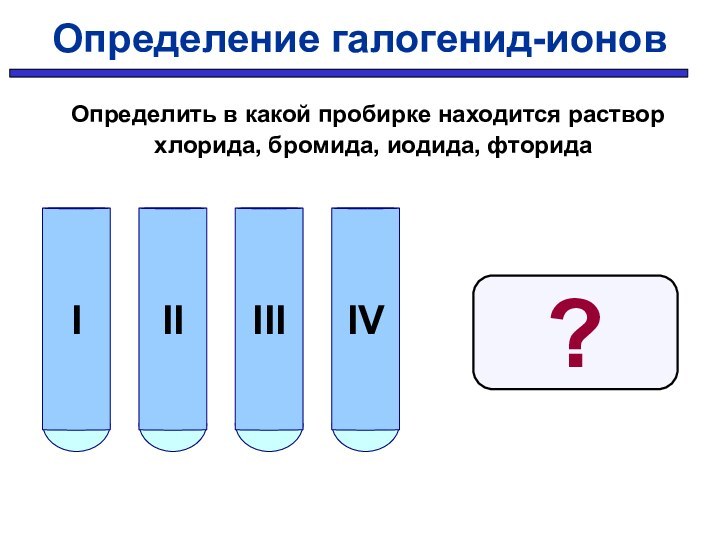
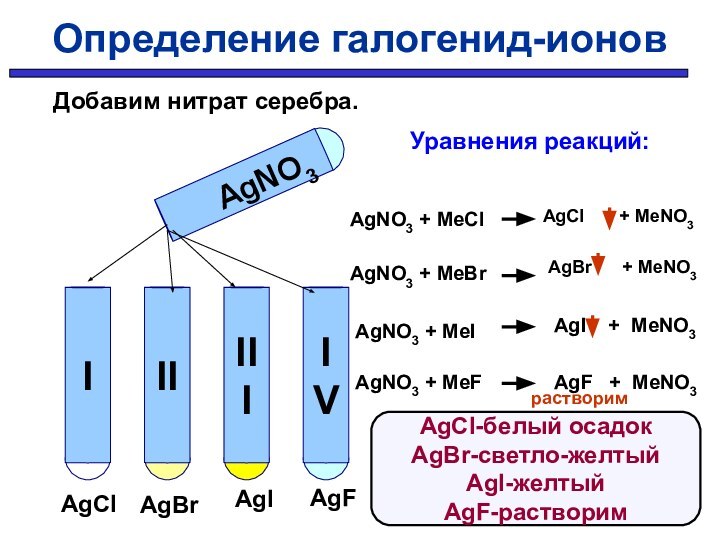
Определение галогенид-ионов
AgCl-белый осадок
AgBr-светло-желтый
AgI-желтый
AgF-растворим
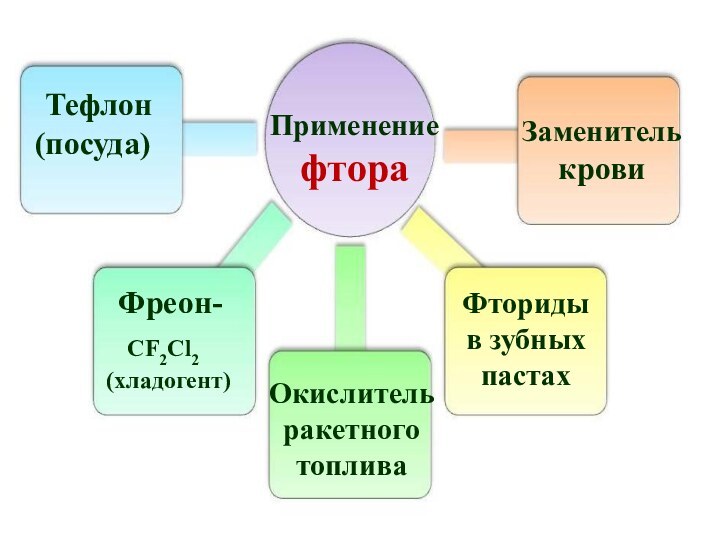
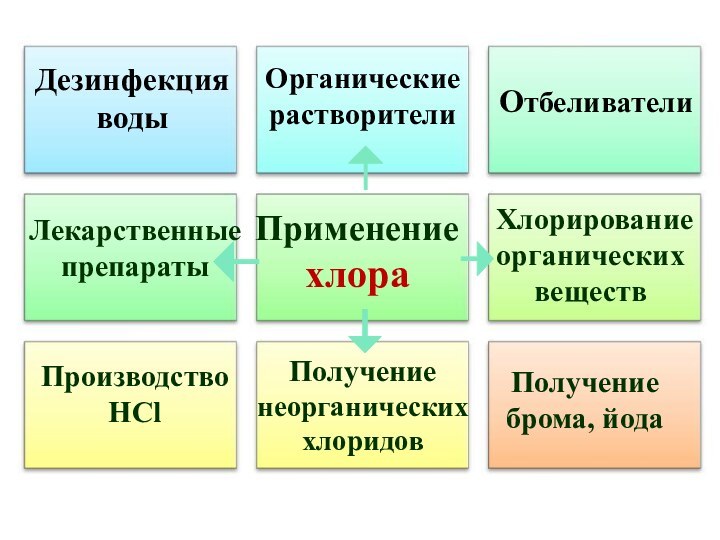
Получение неорганических хлоридов
2H2 O + 2F2 =
2NaOH + H2 +Cl2
2NaCl + I2
XeF4
4 HF + O2
2HF
2AuCl3
Проверь себя
Домашнее задание