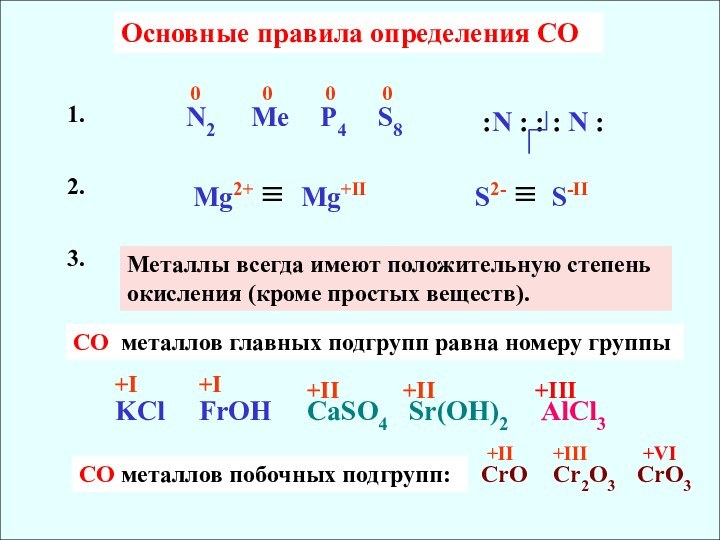
всегда имеют положительную степень окисления (кроме простых веществ).
3.
СO
металлов главных подгрупп равна номеру группыСО металлов побочных подгрупп:
CrO
Cr2O3
CrO3
+II
+III
+VI
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

























СО металлов побочных подгрупп:
CrO
Cr2O3
CrO3
+II
+III
+VI
5.
6.
7.
Максимальная, минимальная, промежуточная СО
Сl: max (+VII), min (-I), промежут.(0, +I, +III, +V)
8.
Дробная СО:
Fe3O4
8/3
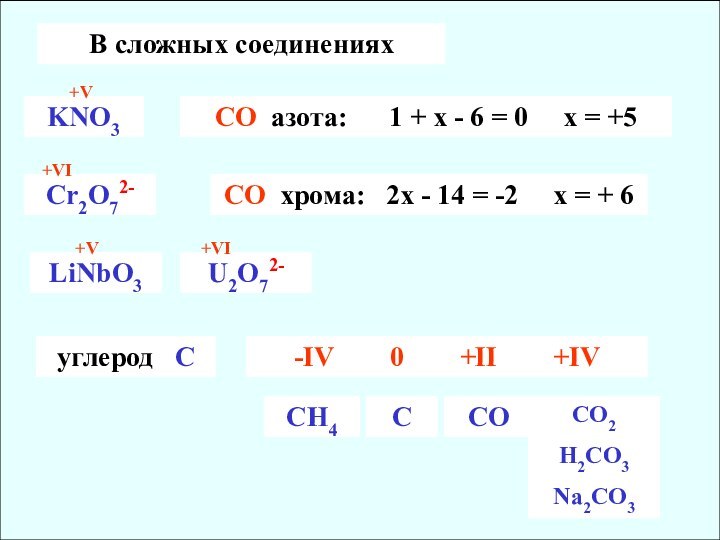
+V
Сr2O72-
CO хрома: 2х - 14 = -2 х = + 6
+VI
LiNbO3
+V
U2O72-
+VI
углерод С
-IV 0 +II +IV
CH4
C
CO
CO2
H2CO3
Na2CO3
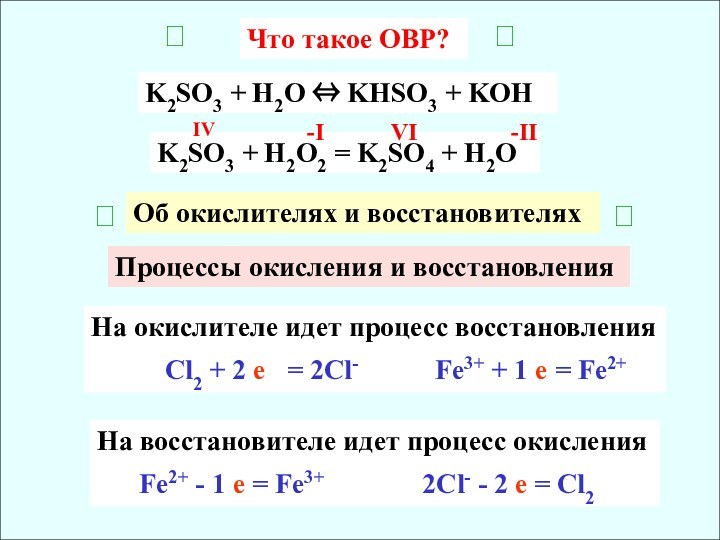
Процессы окисления и восстановления
На окислителе идет процесс восстановления
Cl2 + 2 е = 2Сl- Fe3+ + 1 e = Fe2+
На восстановителе идет процесс окисления
Fe2+ - 1 e = Fe3+ 2Cl- - 2 e = Cl2
Na2S, KI, SnCl2, Fe(NO3)2, NH3, …
-II
-I
-I
+II
+II
-III
Вещества с двойственной природой:
H2O2, SO2, KNO2,
-I
+IV
+III
H2O2 + KI+ H2SO4 = H2O + I2 + K2SO4
-I
-II
окислитель
H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O
восстановитель
-I
0
Главное в металлургии: M+z M0
+ze
-II
0
-II
IV
-II
O20 + 4 e = 2 O-II 3
S-II - 6 e = SIV 2
3O20 + 2S-II =6O-II +2 SIV
2PbS + 3O2 = 2PbO + 2SO2
Cr2O72- + 14H+ + 3SO32- + 3H2O 2Cr3+ + 7H2O + 3SO42- +
6H+
Cr2O72- + 8H+ + 3SO32- 2Cr3+ + 4H2O + 3SO42-
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O
OЭ(KMnO4)
158/5 158/3 158/1
Z – число e
Закон эквивалентов
Nок Vок = Nвосст Vвосст
n окислителя = n восстановителя
Но, катионы Cu2+ в водном растворе более сильный окислитель, чем Fe2+
Fe + CuSO4 → FeSO4 + Cu ↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Исключение – щелочные и щелочно-земельные металлы
3. Все металлы, имеющие отрицательный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот (HCl, HBr, HI, H3PO4, разбавленная H2SO4)
Fe + H2SO4 → FeSO4 + H2 ↑; φ°Fe = -0,44