- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Процессы в растворах: электролитическая диссоциация
Содержание
- 2. Вещества Электролиты - вещества, растворы и расплавы которых
- 3. Неэлектролиты вещества, которые содержат ковалентные неполярные или
- 4. Электролиты Вещества, которые содержат ионные и ковалентные
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
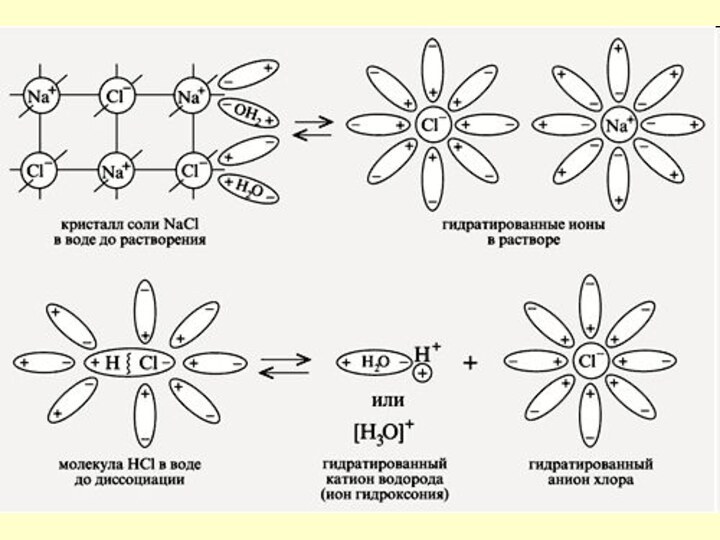
- 6. Вещества с ионной связьюКристаллическая решетка NaClКристалл NaCl
- 7. Механизм ЭД ионных веществ Ориентация диполей
- 8. Na+Cl -Na+Cl -Na+Cl -
- 9. Механизм ЭД полярных веществориентация диполей воды
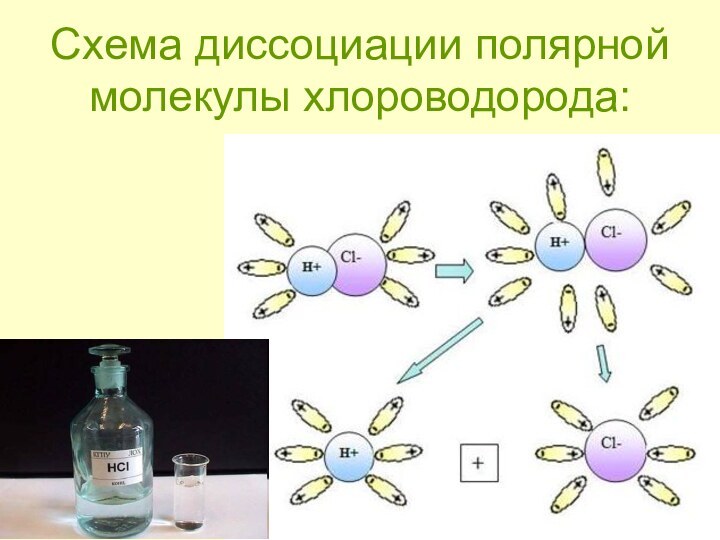
- 10. Схема диссоциации полярной молекулы хлороводорода:
- 11. Электролиты Сильные - при растворении в воде
- 12. Сильные электролиты вещества с ионными или сильно
- 13. Слабые электролитывещества с неполярными и малополярными связями:1) почти
- 14. Степень диссоциации Степень диссоциации (α) - отношение числа
- 15. Электролитическая диссоциация веществ, идущая с образованием свободных
- 16. Диссоциация кислотосуществляется ступенчато. На каждой ступени отщепляется
- 17. Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2
- 18. Диссоциация солейСредние соли – соли, состоящие из
- 19. Диссоциация солейКислые соли – соли, в состав
- 20. Шведский ученый Сванте Аррениус(1859-1927) В 1887 году
- 21. Каблуков И.А. Кистяковский В.А.
- 22. Русские химики И.А.Каблуков и В.А.Кистяковский применили к
- 23. Основные положения теории ЭД 1. Электролиты в
- 25. Основные положения теории ЭД 2. Беспорядочное движение
- 26. Основные положения теории ЭД 3. Диссоциация –
- 27. 4. Степень электролитической диссоциации (a) зависит от
- 28. Основные положения теории ЭД5. Свойства ионов
- 29. Источники информации:http://slovari.yandex.ru/http://www.lyceum8.ru/himiya/4.htmhttp:///fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.htmlhttp://him.1september.ru/2003/34/7.htmhttp:///kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html
- 30. Скачать презентацию
- 31. Похожие презентации
Вещества Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы и расплавы которых не проводят электрический ток.



























Слайд 2
Вещества
Электролиты
- вещества, растворы и расплавы которых не
проводят электрический ток.
которых не проводят электрический ток.
Слайд 3
Неэлектролиты
вещества, которые содержат ковалентные неполярные или малополярные
связи. Эти связи не распадаются на ионы.
газы, твердые
вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Слайд 4
Электролиты
Вещества, которые содержат ионные и ковалентные полярные
связи. Эти связи легко распадаются на ионы.
Неорганические кислоты, основания,
соли.Слайд 5 Электролитическая диссоциация – процесс распада электролита на ионы
при растворении его в воде или расплавлении
Слайд 7
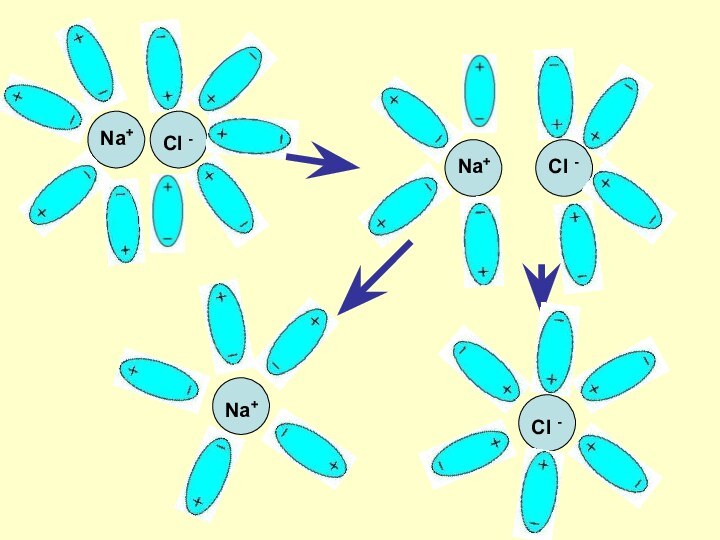
Механизм ЭД
ионных веществ
Ориентация диполей воды вокруг
кристаллов соли.
Образование между молекулами воды и ионами кристаллов слабых
связей.Разрушение кристаллической решетки и образование гидратированных ионов.
Слайд 9
Механизм ЭД
полярных веществ
ориентация диполей воды вокруг полярной
молекулы.
еще большая поляризация полярной молекулы и превращение полярной связи
ее в ионную. образование свободных гидратирован-ных ионов.
Слайд 11
Электролиты
Сильные
- при растворении
в воде практически
полностью
распадаются на
ионы.
Слабые
частично
распадаются на
ионы.
Их растворы содержат ионы и
нераспавшиеся
молекулы, поэтому
концентрация ионов
мала.
Слайд 12
Сильные электролиты
вещества с ионными или сильно полярными
связями.
все хорошо растворимые соли, сильные кислоты (HCl, HBr,
HI, HClO4, H2SO4,HNO3) и сильные основания: LiOH, NaOH, KOH, RbOH, CsOH, Вa(OH)2, Sr(OH)2, Сa(OH)2.
Слайд 13
Слабые электролиты
вещества с неполярными и малополярными связями:
1) почти все
органические кислоты (CH3COOH, C2H5COOH и др.);
2) некоторые неорганические кислоты (H2CO3,
H2S и др.);3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Ca(OH)2; Al(OH)3; NH4OH);
Слайд 14
Степень диссоциации
Степень диссоциации (α) - отношение числа распавшихся
на ионы молекул (n) к общему числу растворенных молекул
(N):Слайд 15 Электролитическая диссоциация веществ, идущая с образованием свободных ионов
объясняет электрическую проводимость растворов.
CaCl2 = Ca2+ + 2Cl-
KAl(SO4)2 =
K+ + Al3+ + 2SO42-HNO3 = H+ + NO3-
Ba(OH)2 = Ba2+ + 2OH-
Слайд 16
Диссоциация кислот
осуществляется ступенчато. На каждой ступени отщепляется один
ион водорода.
H Cl = H+ + Cl -
- H2SO4 = H+ + HSO4- (I ступень)
HSO4- = H+ + SO42- (II ступень)
Кислоты - при диссоциации образуют
катионы водорода и анионы кислотного
остатка.
Слайд 17
Диссоциация оснований
Ba(OH)2 = Ba2+ + 2OH-
Сa(OH)2 =
Сa2+ + 2OH-
Основания - при диссоциации образуют катионы металла
и анионы - гидроксид-ионы.
Слайд 18
Диссоциация солей
Средние соли – соли, состоящие из атомов
металла и кислотного остатка, диссоциируют в одну ступень:
CaCl2
= Ca2+ + 2Cl-KBr = K+ + Br-
NaCl = Na+ + Cl-
Слайд 19
Диссоциация солей
Кислые соли – соли, в состав молекул
которых кроме атомов металла входят атомы водорода, распадаются ступенчато.
Сначала отрываются все атомы металла, а затем атомы водорода по- одному.KHCO3 = K+ + HCO3−
HCO3− = H+ + CO32-
Слайд 20
Шведский ученый Сванте Аррениус(1859-1927)
В 1887 году создал
теорию ЭД.
В 1903году был удостоен Нобелевской премии
"За чрезвычайные
заслуги в развитии химии".Слайд 22 Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению
электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали, что
при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы.
Слайд 23
Основные положения
теории ЭД
1. Электролиты в водной среде
(и в
расплавленном состоянии) распадаются
на положительно заряженные ионы
(катионы) и отрицательно заряженные
ионы (анионы).
Слайд 25
Основные положения
теории ЭД
2. Беспорядочное движение ионов в
растворе под действием электрического поля становится направленным: положительно заряженные
ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду.
Слайд 26
Основные положения
теории ЭД
3. Диссоциация – обратимый процесс:
параллельно с распадом молекул на ионы (диссоциацией) протекает процесс
соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. NaCl Na+ + Cl-Слайд 27 4. Степень электролитической диссоциации (a) зависит от природы
электролита и растворителя, температуры и концентрации. Она показывает отношение
числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).Основные положения
теории ЭД
Слайд 28
Основные положения
теории ЭД
5. Свойства ионов резко отличаются
от
свойств нейтральных атомов
составляющих их элементов. Ионы в
водных растворах гидратированы.





























