Слайд 2
Цель урока:
Повторить и закрепить знания учащихся о свойствах
кислотных оксидов и кислот.
Рассмотреть свойства соединения серы – сернистого
газа и сернистой кислоты его солей.
Рассмотреть влияние сернистого газа на окружающую среду и здоровье человека.
уметь составлять уравнения реакций в молекулярном виде и с точки зрения окислительно - восстановительных процессов.
Нравственное и эстетическое воспитание учащихся к окружающей среде.
Слайд 3
Получение оксидов
1. Горение веществ (Окисление кислородом)
а) простых веществ
Mg
+O2=2MgO
S+O2=SO2
б) сложных веществ
2H2S+3O2=2H2O+2SO2
2.Разложение сложных веществ
а) солей
СaCO3=CaO+CO2
б) оснований
Cu (OH)2=CuO+H2O
в) кислородсодержащих кислот
H2SO3=H2O+SO2
Слайд 4
1)Сероводород горит на воздухе голубым пламенем при этом
образуется сернистый газ или оксид серы(IV)
2H2S-2 + 3O2 →
2H2O + 2S+4O2↑
оксид серы (IV)
2) При сгорании ее на воздухе или в кислороде образуется оксид серы (IV) SО2 и частично оксид серы (VI) SO3:
S + O2 = SO2
оксид серы (IV)
Слайд 5
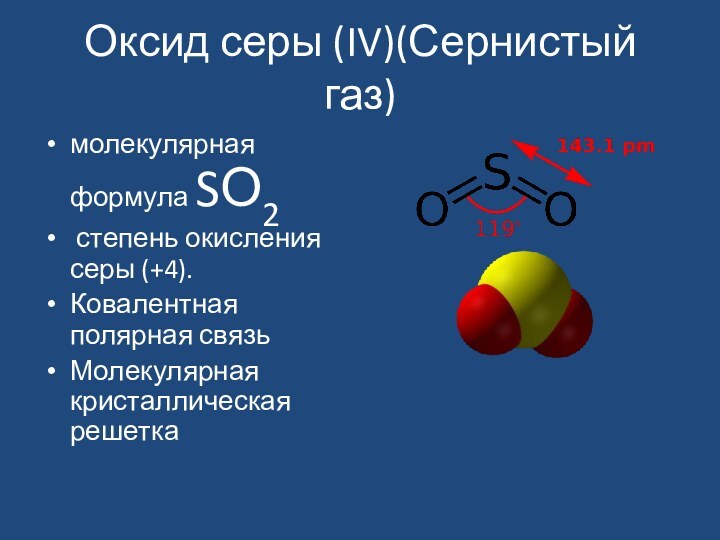
Оксид серы (IV)(Сернистый газ)
молекулярная формула SО2
степень окисления
серы (+4).
Ковалентная полярная связь
Молекулярная кристаллическая решетка
Слайд 6
Электронный баланс
1)S-2 -6е→ S+4 Восстановитель
O2+4е → 2O -2 Окислитель
2) S0 -4е→
S+4 Восстановитель
O2+4е → 2O -2 Окислитель
Слайд 7
Определение плотности по воздуху.
Д воздух -?
М(Воздух)= 29 г/моль
М(H2S)=64г/моль
Д
воздух = 64:29=2,21
Д воздух =2,21
Вывод: Сернистый газ тяжелее воздуха
более чем в два раза
Слайд 8
Получение сернистого газа в промышленности.
сжигание серы или обжиг
сульфидов, в основном — пирита:
4FeS2+ 11O2 = 2Fe2O3 + 8SO2
ZnS
+ O2 = ZnO + SO2
Слайд 9
Получение оксида серы (IV) в лабораторных условиях
воздействием сильных
кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота- H2SO3
сразу разлагается на SO2 и H2O:
Na2SO3 + H2SO4 = Na2SO4 + H2SO3
Также действием концентрированной серной кислоты на малоактивные металлы при нагревании
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Слайд 10
Физические свойства.
Оксид серы (IV), или сернистый газ,
при нормальных условиях представляет собой бесцветный газ с характерным
резким запахом (запах загорающейся спички), более чем в 2 раза тяжелее воздуха, растворяется в воде. Ядовит. При охлаждении до -10°С сжижается в бесцветную жидкость. Растворяется в воде с образованием нестойкой сернистой кислоты, растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте.
Слайд 12
Химические свойства кислотных оксидов
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
1. Кислотный
оксид +Вода= Кислота (р. соединения)
СO2 + H2O = H2CO3,
SiO2 – не реагирует
2. Кислотный оксид + Основание = Соль + Н2О (р. обмена)
P2O5 + 6KOH = 2K3PO4 + 3H2O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
4. Менее летучие вытесняют более летучие из их солей
CaCO3 + SiO2 = CaSiO3 +CO2
Слайд 13
Химические свойства оксида серы (IV)
1. Кислотный оксид
+Вода= Кислота
SO2 + H2O = H2SO3
2. Кислотный
оксид + Щелочь = Соль + Н2О
SO2 + 2KOH = K2SO3 + H2O
SO2 + 2OH - = SO3 2- + H2O
3. Основной оксид + Кислотный оксид = Соль
CaO + SO2 = CaSO3
Слайд 14
Химические свойства кислот
1. Изменяют окраску индикатора.
2.Реагируют с металлами
в ряду активности до H2 (искл. HNO3 –азотная кислота)
Ме
+ КИСЛОТА =СОЛЬ + H2↑ (р. замещения)
3. С основными (амфотерными) оксидами
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
5. Реагируют с солями слабых, летучих кислот - если образуется соль, выпадающая в осадок или выделяется газ: ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании
( искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Слайд 15
Уравнение диссоциации сернистой кислоты.
H2SО3 → H+ +
HSО3 -
HSО3 - ↔ H+ + SО3
2-
Это кислота средний силы, существует только в водных растворах.
Она дает 2 типа солей:
HSО3 - SО3 2-
гидросульфиты сульфиты
Слайд 16
Качественная реакция на сульфиты.
Взаимодействие соли с сильной кислотой,
при этом выделяется газ с резким запахом
Na2SO3+H2SO4=Na2SO4+S02+H2O
2NaHSO3+H2SO4=Na2SO4+2SO2+2H2O
2HSO3-+2H+=2SO2+2H2O
Слайд 17
Окислительные свойства оксида серы (IV).
2H2S-2 + S +4O2
→ 2H2O + 3S 0
S+4 +4е→ S0 Окислитель
S-2
-2е→ S0 Восстановитель
Слайд 18
Восстановительные свойства оксида серы (IV)
2SO2+ O2 = 2SO2
SO2
+ Br2 + 2H2O = H2 SO4 + 2HBr
5 SO2 + 2KMn SO4 + 2H2O = 2H2SO4 + 2Mn SO4 + K2 SO4
S+4 - 2е→ S+6 Восстановитель
Слайд 19
Применение оксида серы (IV).
Большая часть оксида серы (IV)
используется для производства серной кислоты. Используется также в качестве
консерванта (пищевая добавка Е220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты.
Слайд 20
Физиологическое действие на организм.
SO2 очень токсичен. Симптомы при
отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в
горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отек легких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу береза и дуб, наименее — роза, сосна и ель.
Слайд 21
Воздействие
на атмосферу.
Из-за образования в больших количествах в

качестве отходов диоксид серы является одним из основных газов,
загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие ее в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.