- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Строение электронных оболочек атомов
Содержание
- 2. Строение электронных оболочек атомовЗадачи урока:Познакомиться со строением электронных оболочек атомовНаучиться составлять схемы строения электронных оболочек
- 3. Соотнесите химические формулы и формы существования химических
- 4. Энергетический уровень (электронный слой) – это…Be )
- 5. Число энергетических уровней = номеру периодаМаксимальное число
- 6. Запишите схемы строения электронных оболочек атомов: углерода,
- 7. Повторение1. Электроны в атомах располагаются …2. Электроны
- 8. Электронная облако. Электронная орбиталь+S - орбиталь
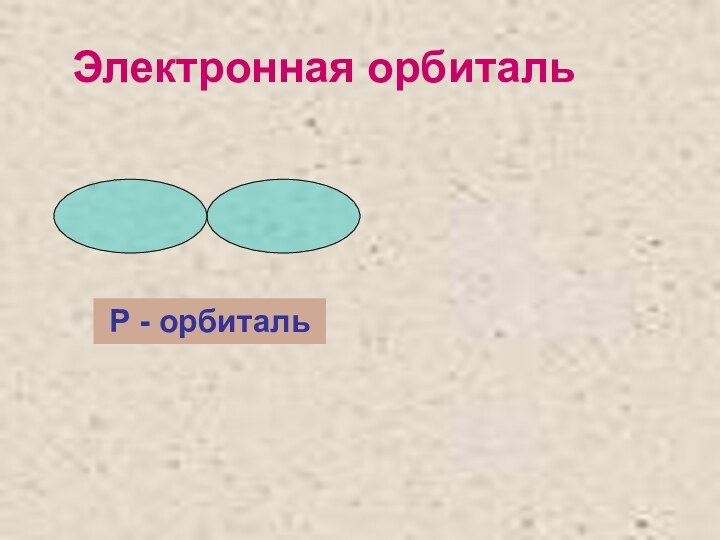
- 9. Электронная орбитальР - орбиталь
- 10. Электронная орбитальР - орбитали
- 11. На одной орбитали не может находится более
- 12. Электронные формулыH )1 1S1He )2 1S2C )2 )4 1S2 2S22P2OFNa
- 13. Повторение 1. Пространство вокруг ядра атома ,где
- 14. Скачать презентацию
- 15. Похожие презентации
Строение электронных оболочек атомовЗадачи урока:Познакомиться со строением электронных оболочек атомовНаучиться составлять схемы строения электронных оболочек













Слайд 2
Строение электронных оболочек атомов
Задачи урока:
Познакомиться со строением электронных
оболочек атомов
Слайд 3
Соотнесите химические формулы и формы существования химических элементов
1)
2S
2) S8
3) 3H2O
4) Al2O3
5) 2Al
6) CuO
1) свободные атомы
2) простые
вещества3) сложные вещества
1
2
3
3
1
3
Слайд 5
Число энергетических уровней = номеру периода
Максимальное число электронов
на уровне = 2 n2
1 уровень – 2 электрона
2
уровень – 8 электронов3 уровень – 18 электронов
Максимальное число электронов на внешнем уровне - 8
Завершенный уровень -…
Слайд 6 Запишите схемы строения электронных оболочек атомов: углерода, азота,кислорода,
фтора.
Соотнесите число электронов на внешнем уровне и номер группы
Число
электронов на внешнем уровне равно номеру группы
Слайд 7
Повторение
1. Электроны в атомах располагаются …
2. Электроны одного
энергетического уровня имеют примерно одинаковый …
3. Число уровней равно
….4. Максимальное число электронов на уровне = …
5. Уровень, содержащий максимальное количество электронов называют …
6. Завершенный внешний уровень содержит ….. электронов
7. Число электронов на внешнем уровне = …
Слайд 11 На одной орбитали не может находится более 2
электронов
Количество орбиталей на уровнях равно номеру уровня.
1 уровень –
S - орбиталь2 уровень – S, P - орбитали
Слайд 13
Повторение
1. Пространство вокруг ядра атома ,где наиболее
вероятно нахождение электрона называют ….
2. S и P –
орбитали различаются ….3. Каждый уровень начинается ... орбиталью
4. На S – орбитали может находиться …. электрона, на Р – орбиталях - …. Электронов
5. Объясните, что обозначают цифры и буквы в записи: 1S2 2S22P2





























