- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Содержание
- 2. Ионные реакции – реакции протекающие между ионами в растворе.
- 3. Порядок составления ионных уравнений реакции.1. Записывают молекулярное
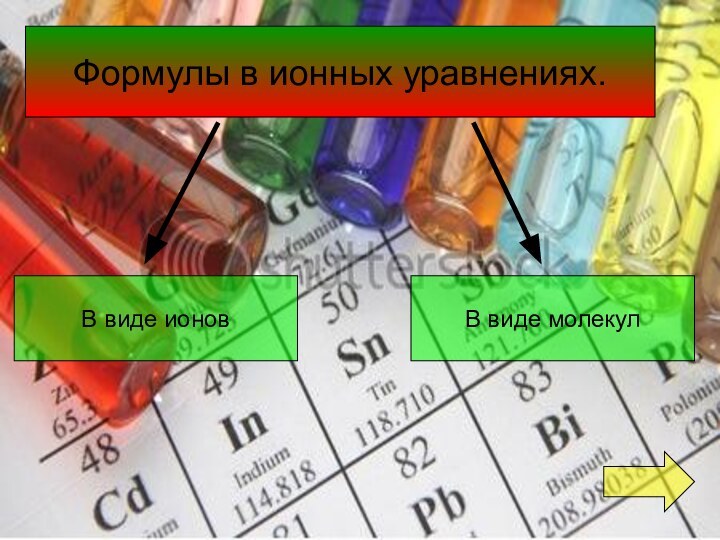
- 4. Формулы в ионных уравнениях.В виде ионовВ виде молекул
- 5. Сильных кислот:(HClO4, H2SO4, HNO3, HI и др.);Сильных
- 6. Большая часть молекул слабых электролитов в растворе
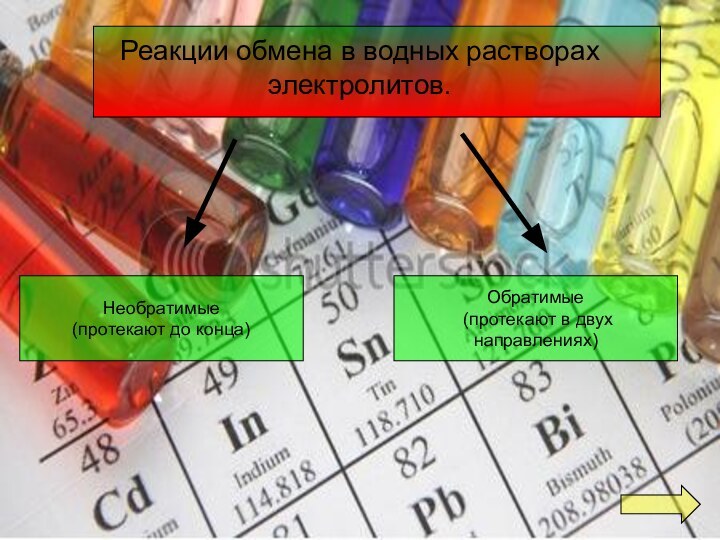
- 7. Реакции обмена в водных растворах электролитов.Необратимые(протекают до конца)Обратимые (протекают в двух направлениях)
- 8. Необратимыми являются реакции между сильными электролитами, в
- 9. б) Реакции, идущие с образованием малодиссоциирующих веществ
- 10. в) Реакции, протекающие с образованием газообразных веществ.NaOH
- 11. Реакции обмена, если среди
- 12. Если исходными веществами реакций обмена являются сильные
- 13. Скачать презентацию
- 14. Похожие презентации
Ионные реакции – реакции протекающие между ионами в растворе.











Слайд 3
Порядок составления ионных уравнений реакции.
1. Записывают молекулярное уравнение
реакции
2. Определяют растворимость каждого из веществ с помощью таблицы
растворимости3. Записывают уравнения диссоциации растворимых в воде исходных веществ и продуктов реакции:
4. Записывают полное ионное уравнение реакции
5. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон:
Слайд 5
Сильных кислот:(HClO4, H2SO4, HNO3, HI и др.);
Сильных оснований:(
щелочей - CsOH, NaOH, KOH, Ca(OH)2 и др.);
Растворимых в
воде солей : ( NaBr, KNO3, BaCl2, Al2(SO4)3 и др.).
Слайд 6
Большая часть молекул слабых электролитов в растворе не
диссоциирует на ионы
Воды H2O;
Слабых кислот (HNO2, HCN, H3PO4, H2SO3,
CH3COOH и др.);Слабых оснований (NH4OH, Fe(OH)2, Cu(OH)2, и др.);
Малорастворимых солей(↓): AgCl , BaSO4, CaCO3, FeS и др.
Амфотерных гидрооксидов (↓): Al(OH)3, Zn(OH)2, Cr(OH)3 и др.
Формулы газообразных веществ( CO2, SO2, H2, H2S, NH3 и др.)
Формулы оксидов металлов и неметаллов (Na2O, CaO, P2O5, SiO2, B2O3 и т.д)
Слайд 7
Реакции обмена в водных растворах электролитов.
Необратимые
(протекают до конца)
Обратимые
(протекают в двух направлениях)
Слайд 8
Необратимыми являются реакции между сильными электролитами, в результате
которых образуются:
Реакции с образованием малорастворимых веществ, выпадающих в осадок
(↓).AgNO3 + NaCl = AgCl + NaNO3
Ag+ + NO3- + Na+ + CI- = AgCl↓+ Na+ + NO3
Ag+ + CI- = AgCl↓
Слайд 9
б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых
электролитов)
2NaOH + H2SO4 = Na2SO4 + 2Н20
2Na+ +
2ОН- + 2Н+ + S042- = 2Na+ + S042- + 2Н202ОН- +2 Н+ = 2Н20
ОН- + Н+ = Н20
Слайд 10
в) Реакции, протекающие с образованием газообразных веществ.
NaOH +
NH4CI = NaCl + NH3 ↑ + Н20
Na+ +
ОН- + NH4+ + CI- = Na+ + CI- + NH3 ↑ + Н20NH4+ + OH- = NH3 ↑ + Н20
Угольная, сернистая кислоты и гидроксид аммония неустойчивые соединения и распадаются:
H2CO3 → CO2 ↑ + H2O
H2SO3 → SO2 ↑ + H2O
NH4OH → NH3 ↑ + Н20
Слайд 11
Реакции обмена, если среди
исходных веществ имеются слабые электролиты или
малорастворимые вещества, являются обратимыми, т.е. до конца не протекают.а) СH3COOH+KOH CH3COOK+H2O
СH3COOH+OH- CH3COO-+H2O
б) Cu(OH)2 +2HCl CuCl2+2 H2O
Cu(OH)2 +2H+ Cu 2+ + 2H2O
Слайд 12
Если исходными веществами реакций обмена являются сильные электролиты,
которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ,
то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются с друг другом.2NaCl+Ca(NO3)2 ≠ 2NaNO3 +CaCl2
2Na++2Cl-+Ca 2+ + 2NO3 - ≠ 2Na++ 2NO3 - + Ca 2+ + 2Cl-