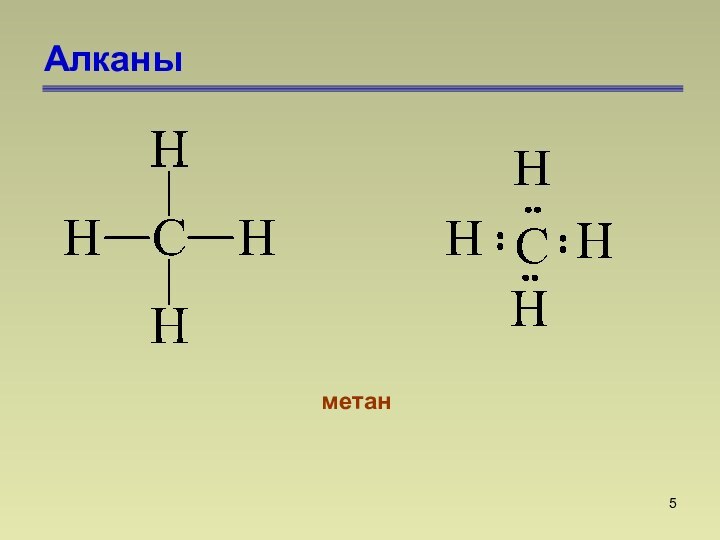
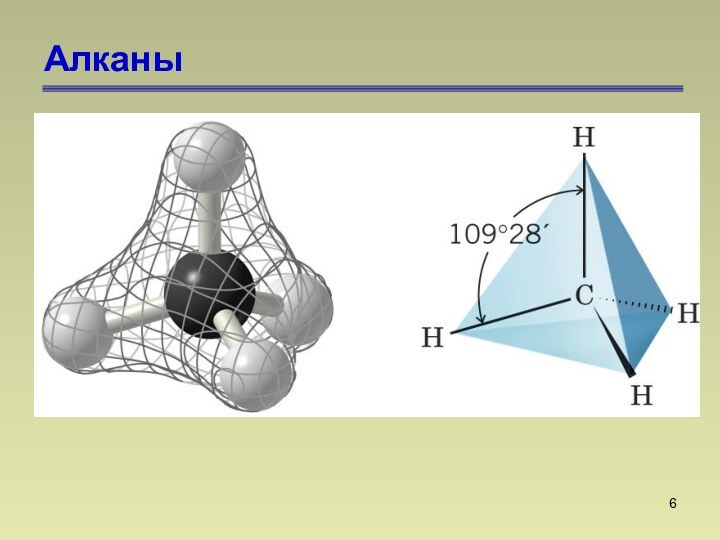
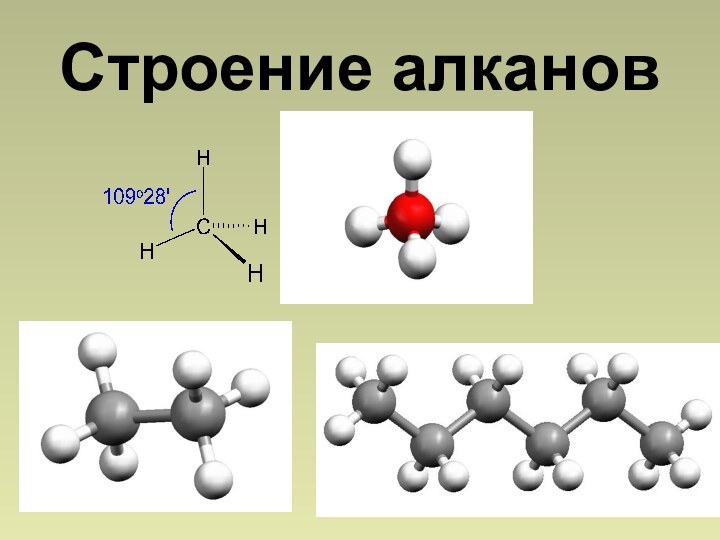
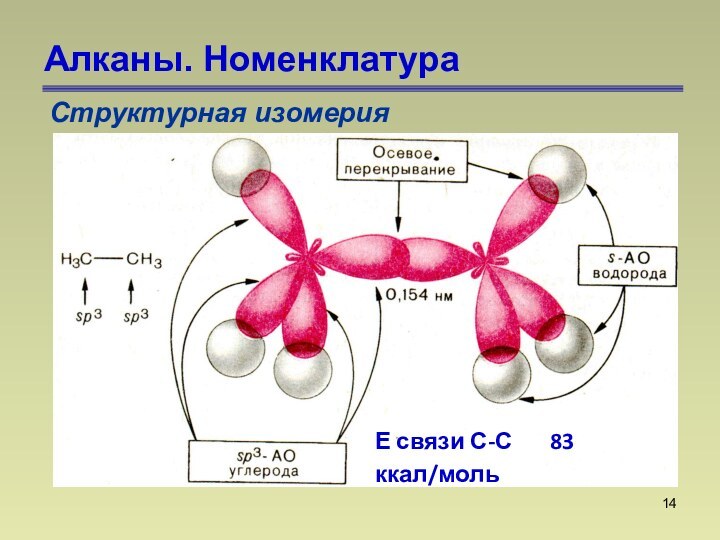
состоят из атомов углерода и водорода, связанных между собой
только -связями.СnН2n+2
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


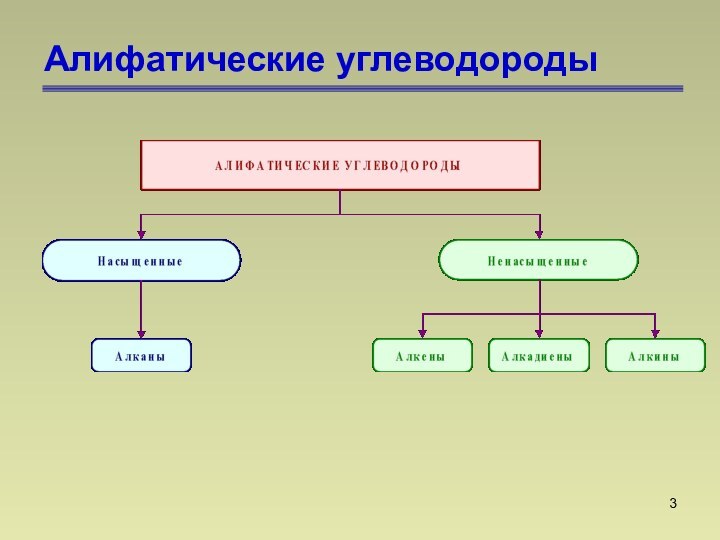

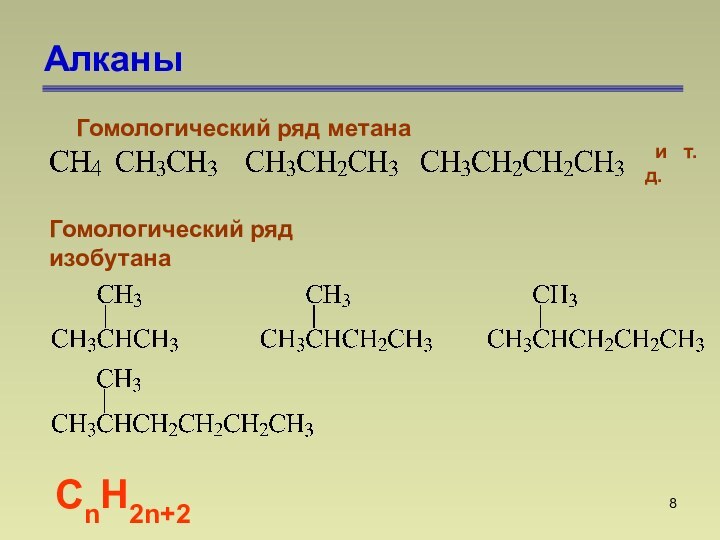

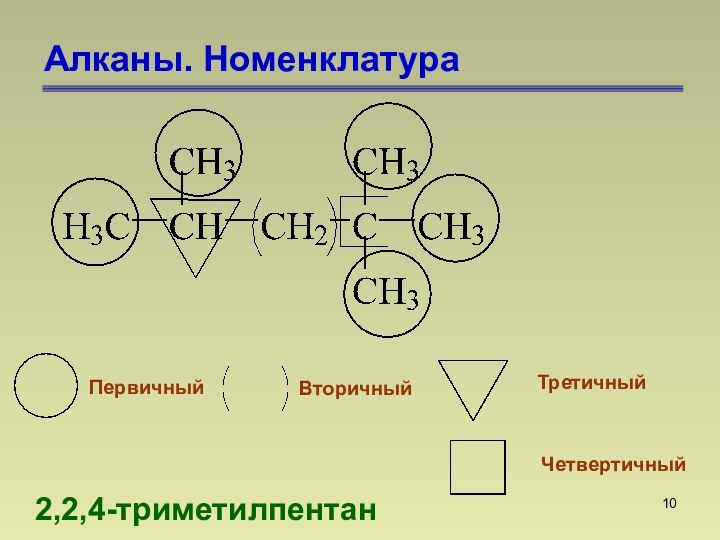

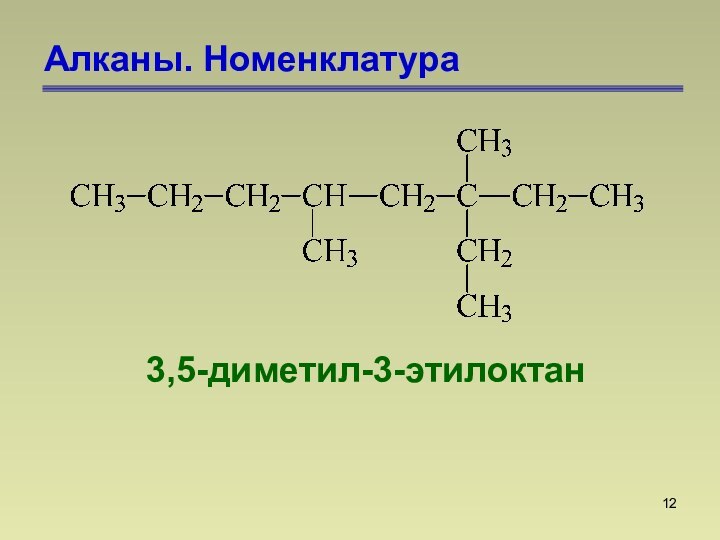
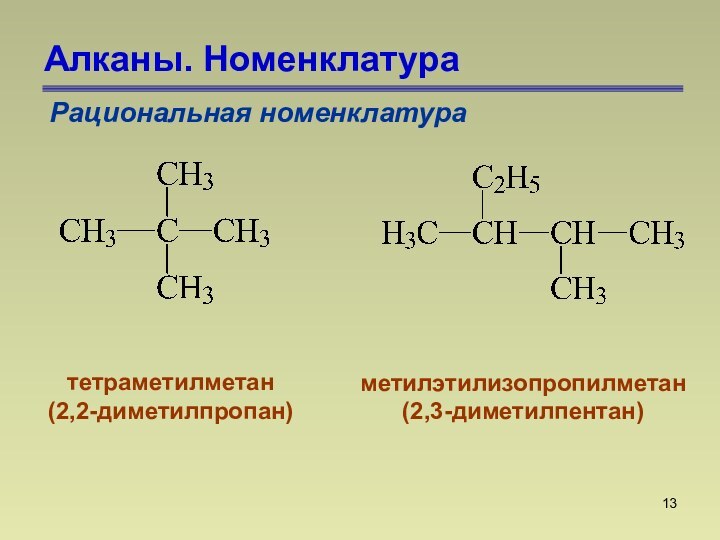
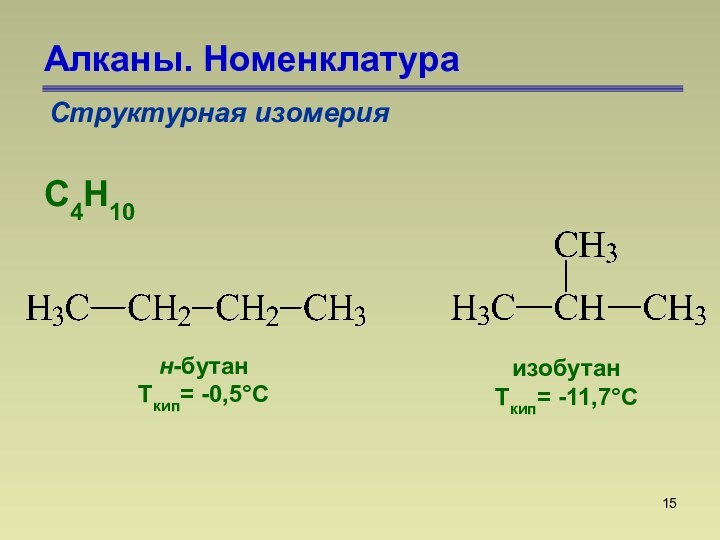
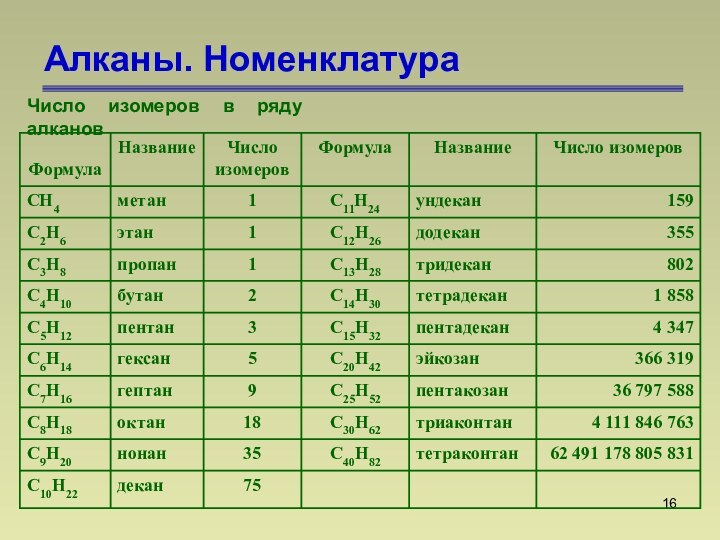
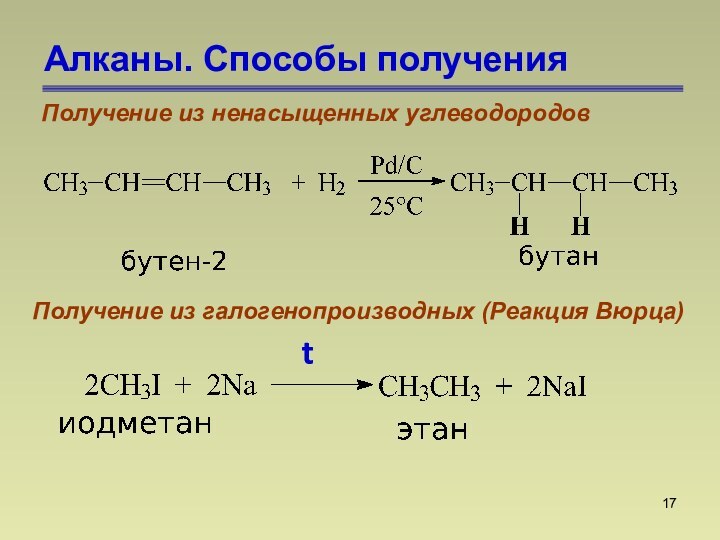

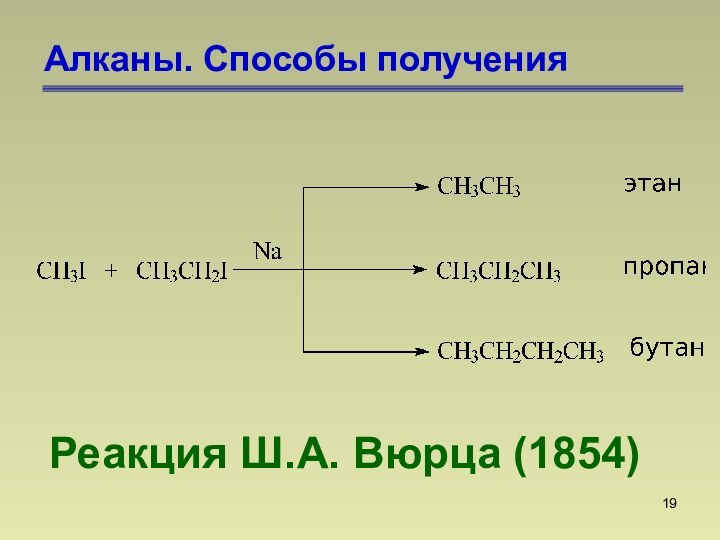
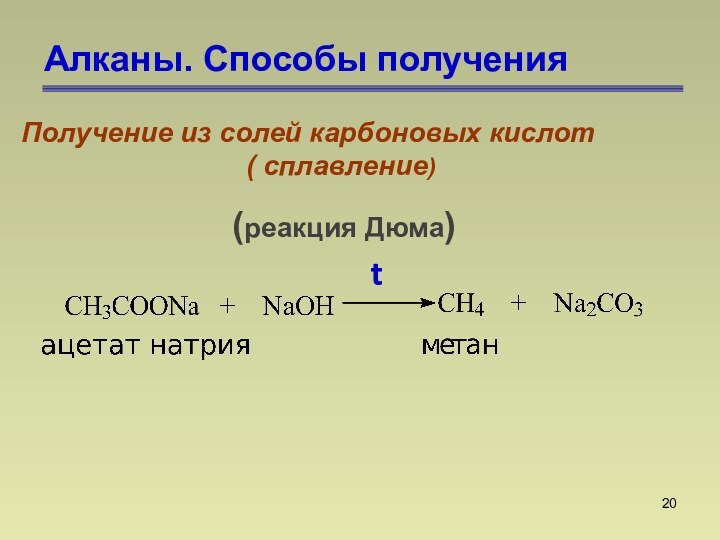



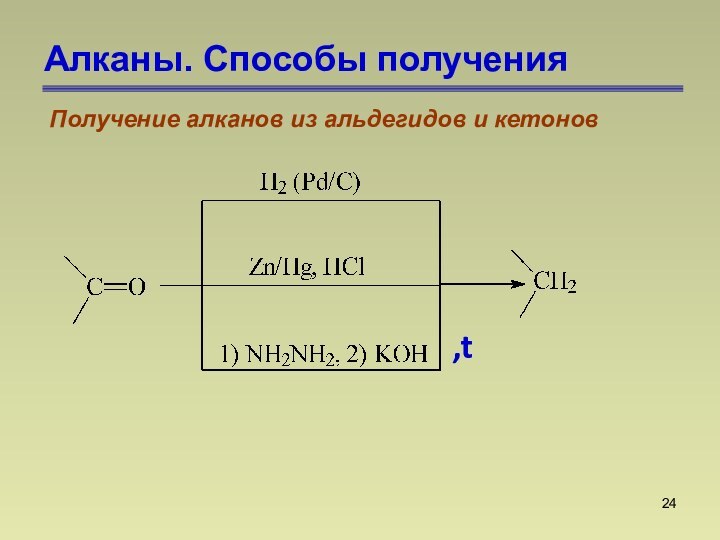

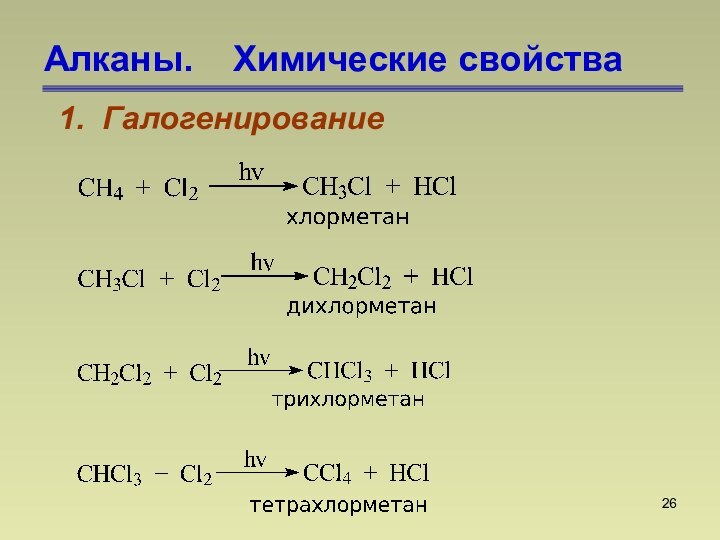







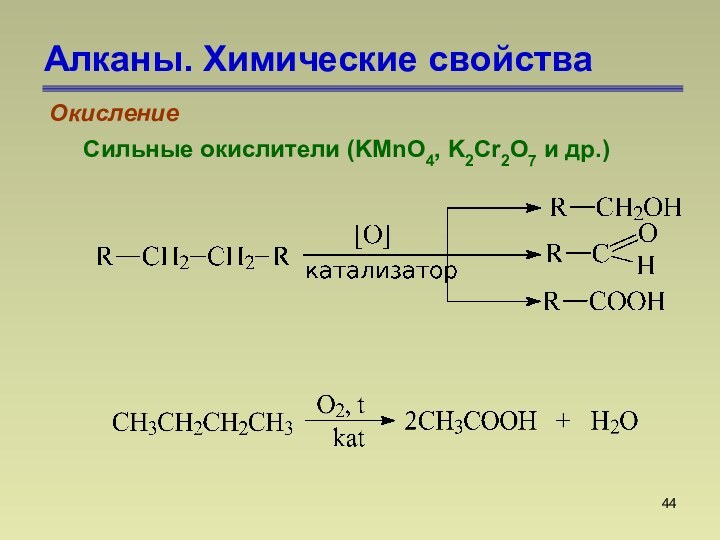
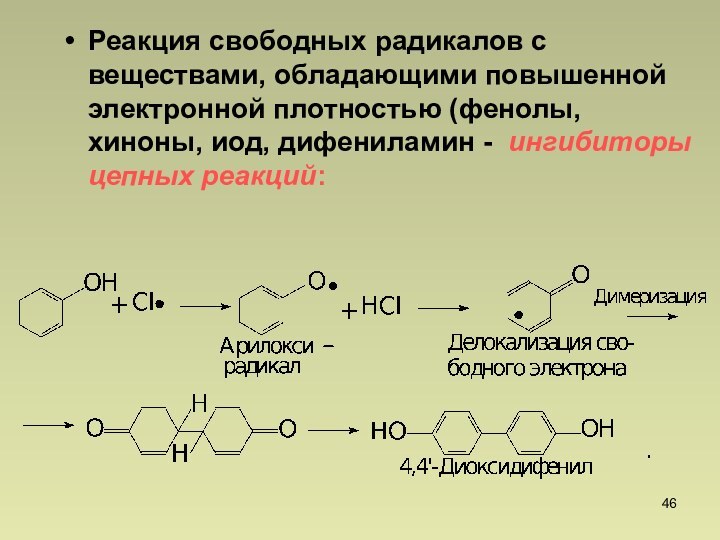
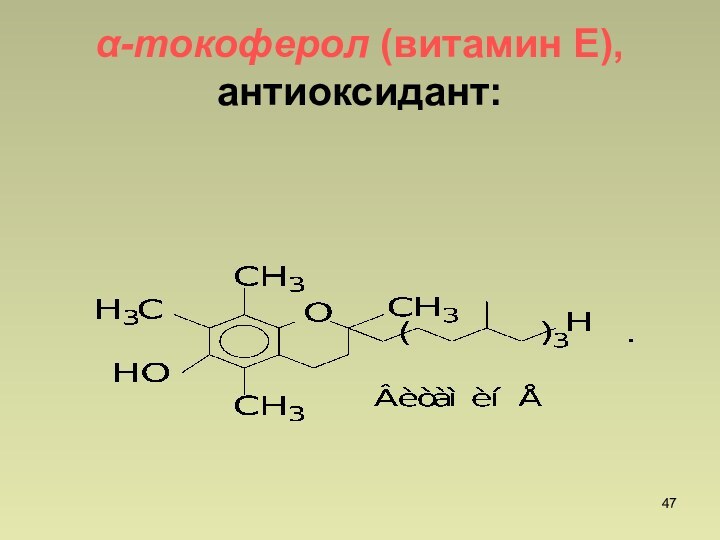

СnН2n+2
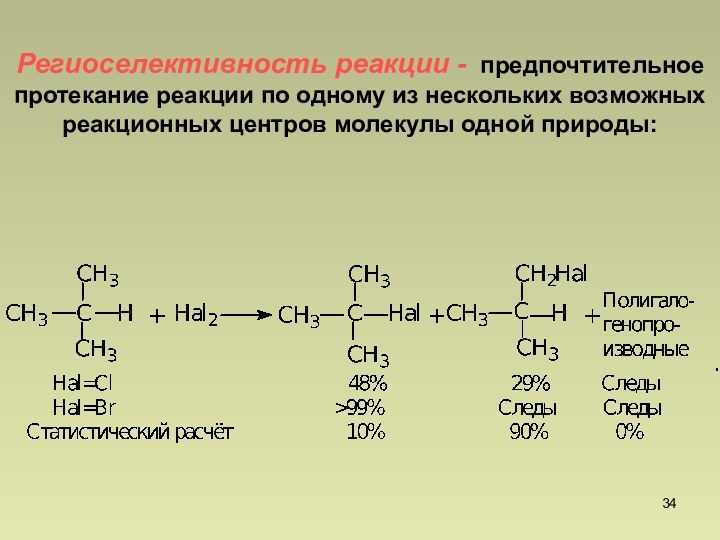
Региоселективность любой органической реакции понижается с увеличением активности реагента
СН3СН2СН2СН2Cl.
25% 50% 17% 3%
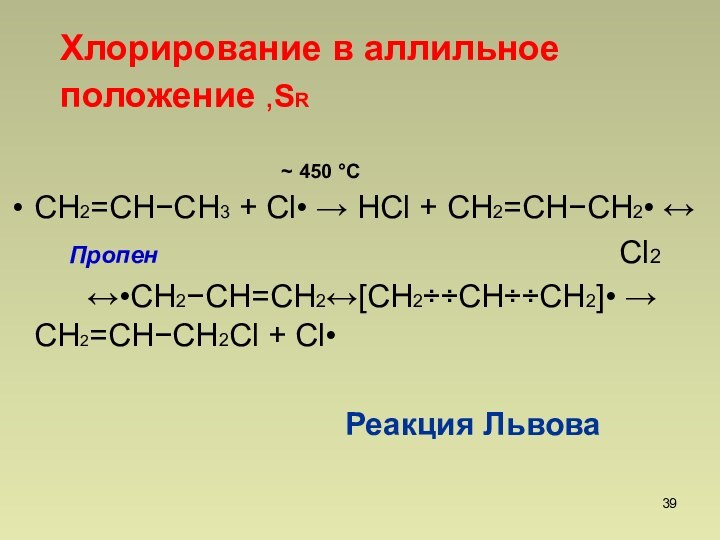
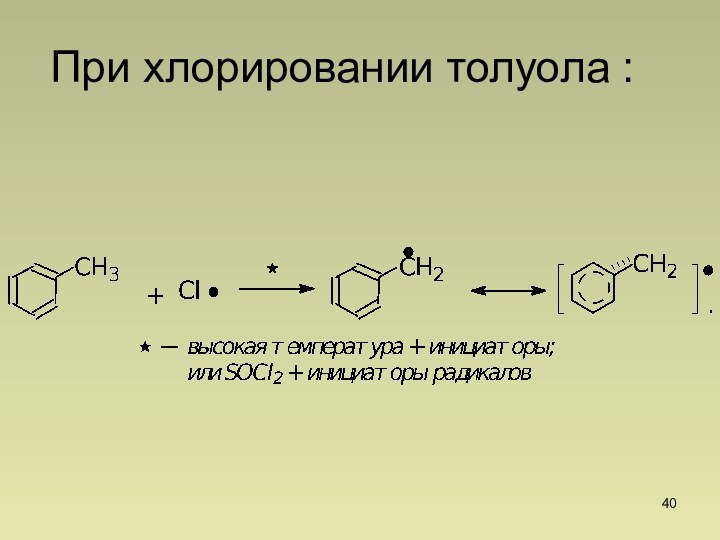
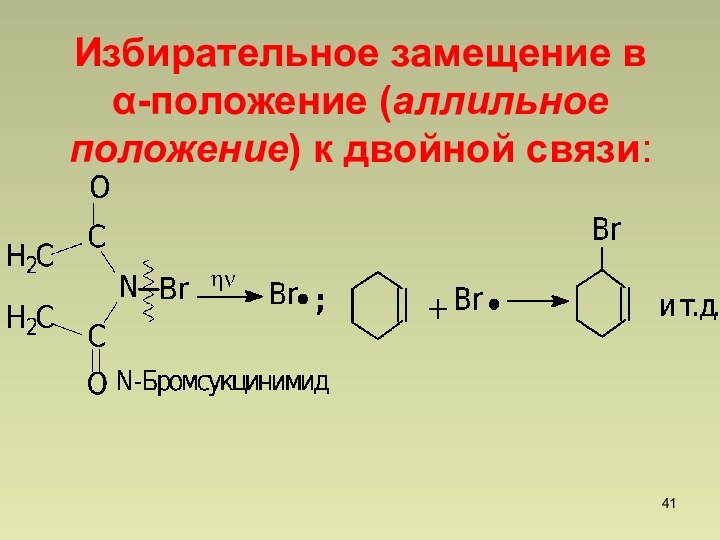
Хлорирование в аллильное положение ,SR
450 С
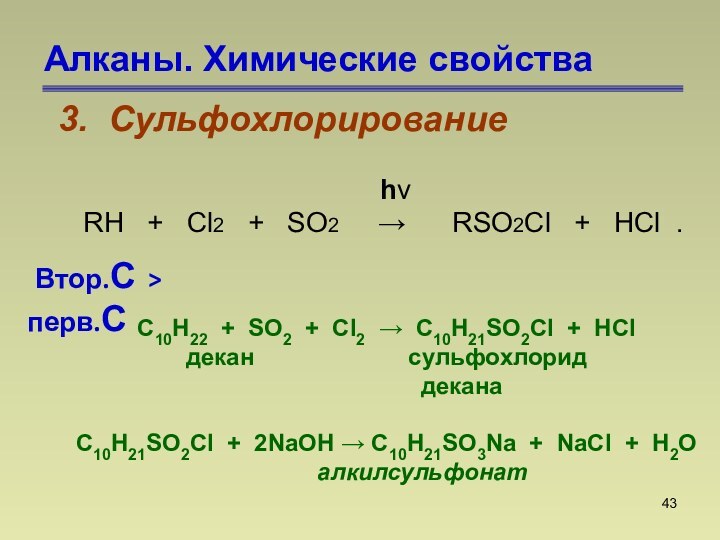
hν
RH + Cl2 + SO2 → RSO2Cl + HCl .
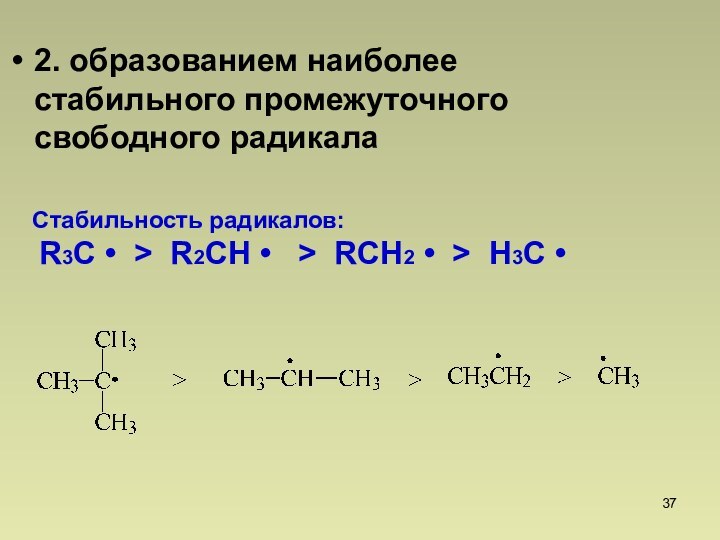
Втор.С > перв.С
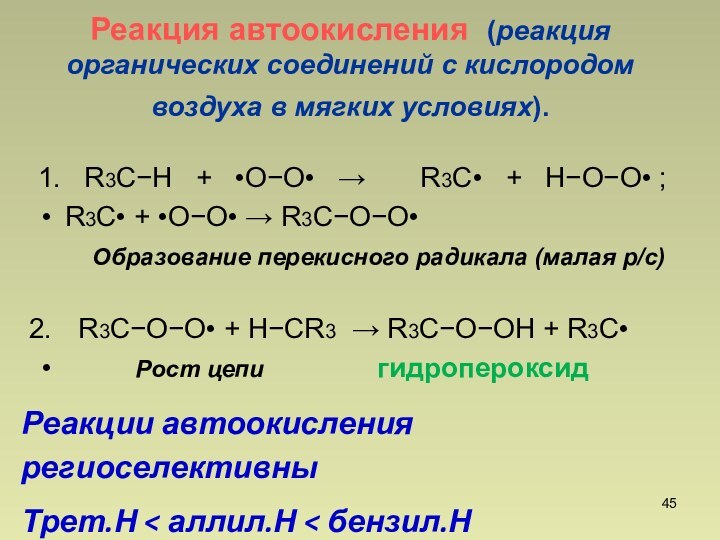
Реакции автоокисления региоселективны
Трет.Н < аллил.Н < бензил.Н