- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
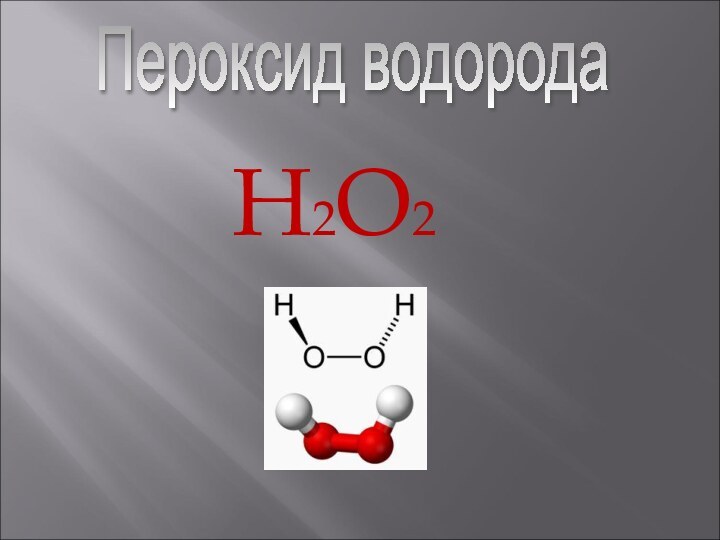
Презентация на тему Пероксид водорода
Содержание
- 2. Пероксид водорода (перекись водорода), H2O2 — простейший представитель пероксидов.
- 3. Бесцветная жидкость с «металлическим» вкусом. Неограниченно растворимая в воде, спирте и эфире.Физические свойства
- 4. Разлагается при хранении на свету, при нагревании,
- 5. Раствор Н2О2 имеет кислую реакцию среды
- 6. ПолучениеВ промышленности: каталитическое окисление изопропилового
- 7. в аналитической химии, в качестве пенообразователя
- 8. Опасность примененияКонцентрированные растворы Н2О2 вызывают ожоги. В больших концентрациях Н2О2 взрывоопасен.
- 9. Н2О2 – окислитель или восстановитель ?
- 10. Скачать презентацию
- 11. Похожие презентации
Пероксид водорода (перекись водорода), H2O2 — простейший представитель пероксидов.
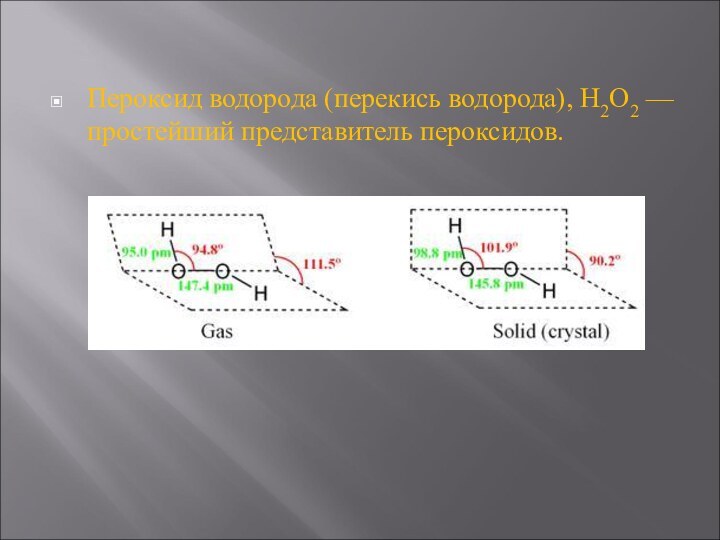








Слайд 3
Бесцветная жидкость с «металлическим» вкусом.
Неограниченно растворимая в
воде, спирте и эфире.
Физические свойства
Слайд 4 Разлагается при хранении на свету, при нагревании, под
действием ультрафиолетового излучения, в присутствии ионов переходных металлов :
2Н2O2 → 2H2O + O2
Проявляет свойства окислителя
Н2О2 + KNO2 → KNO3 + H2O
Н2О2 + 2KJ → J2 + 2KOH
Проявляет свойства восстановителя
5Н2О2 + 2KMnO4 + 3Н2SO4 → 2MnSO4 + 5O2 + +K2SO4+ 8H2O
Химические свойства
Слайд 5
Раствор Н2О2 имеет кислую реакцию среды
Н2О2 Н+ + НО2 (Кдисс
= 1,5·10-12)Как кислота
Н2О2 + Ва(ОН)2 → ВаО2 + 2Н2О
Соли слабой кислоты
ВаО2 + Н2SO4 → BaSO4 + H2O2
Слайд 6
Получение
В промышленности:
каталитическое окисление изопропилового спирта:
CH3СНОНСН3 + O2 → CH3COCH3
+ H2O2В лаборатории :
BaO2 + H2SO4 → H2O2 + BaSO4
Концентрирование и очистку Н2О2 проводят осторожной перегонкой.
Слайд 7
в аналитической химии,
в качестве пенообразователя
в
производстве дезинфицирующих и
отбеливающих средств.ракетное топливо
в медицине
Применение
Слайд 8
Опасность применения
Концентрированные растворы Н2О2
вызывают ожоги.
В больших
концентрациях Н2О2 взрывоопасен.
Слайд 9
Н2О2 – окислитель или восстановитель ?
KNO2 + H2O2 → KNO3 + H2O
KMnO4 + H2O2 + HNO3 → Mn(NO3)2 + O2 +KNO3+ + H2O
Задание