которых содержат атомы водорода и кислотный остаток
H-R, где R-кислотный
остатокПри электролитической диссоциации кислот в водном растворе образуются катионы водорода и анион кислотного остатка
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




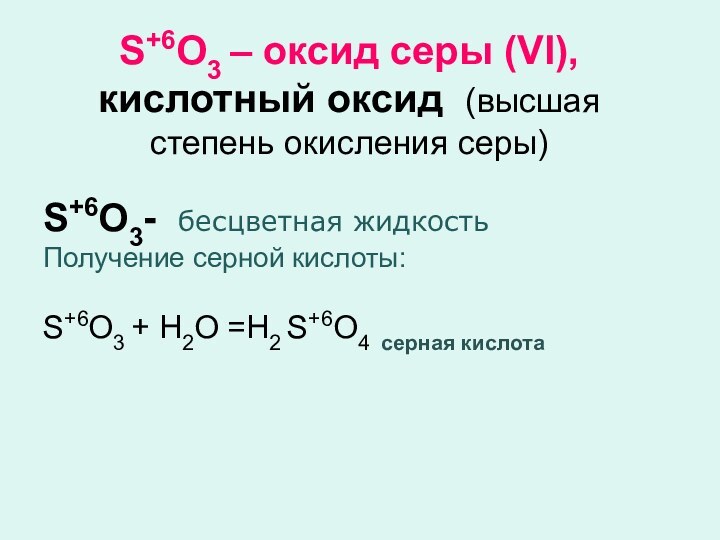








Кислородные кислоты, например, H2CO3, H3PO4 (отвечают кислотным оксидам и являются фактически кислотными гидроксидами)
Бескислородные кислоты, например, HBr, H2S (относятся к числу бинарных соединений)