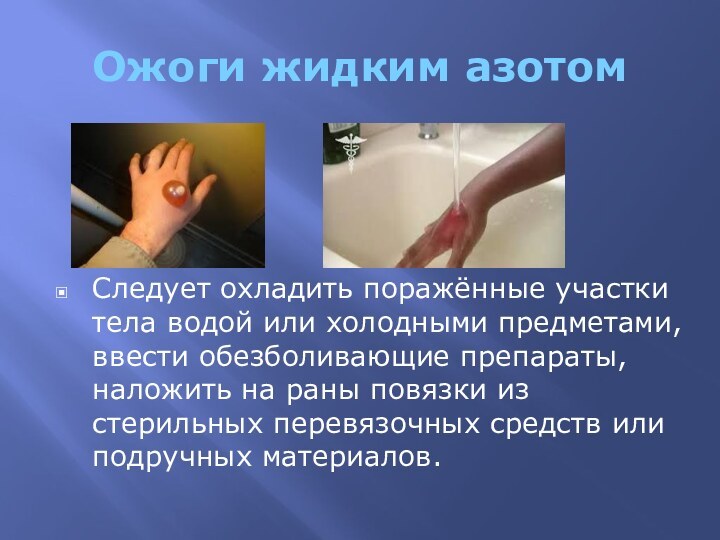
Испаряясь, азот охлаждает очаг возгорания и вытесняет кислород, необходимый
для горения, поэтому пожар прекращается. Так как азот, в отличие от воды, пены или порошка, просто испаряется и выветривается, азотное пожаротушение, наряду с углекислотным, — наиболее эффективный с точки зрения сохранности ценностей способ тушения пожаров.жидкость прозрачного цвета. Имеет точку кипения −195,75 °С