ниже диагонали B – Si – As – Te
– At.Li
Fr
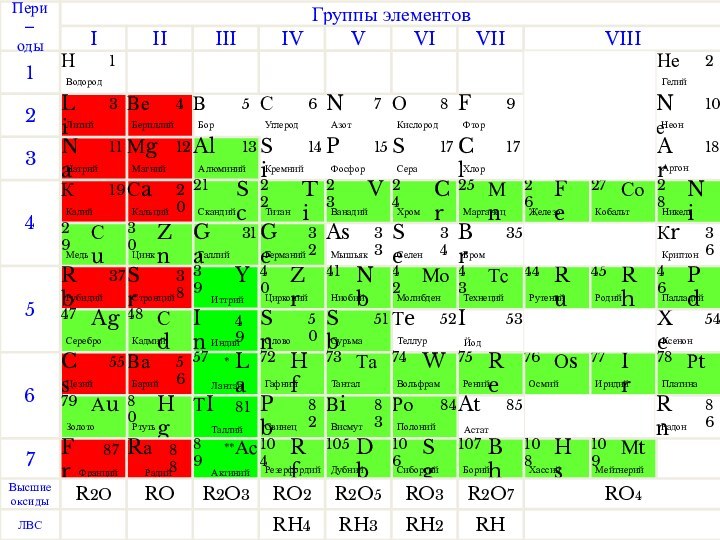
Металлы составляют все побочные подгруппы.
Положение металлов в ПСХЭ
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




















Li
Fr
Металлы составляют все побочные подгруппы.
Положение металлов в ПСХЭ
М0 ─ nе ↔ Мn+
атом катион
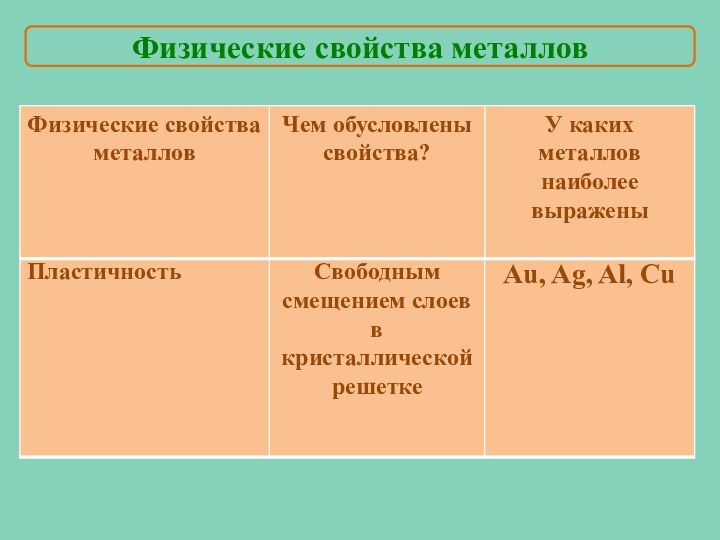
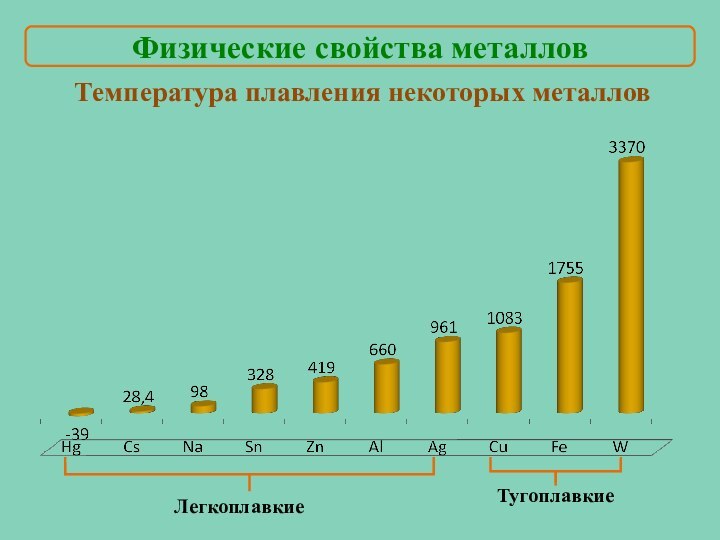
Мы знаем, что…
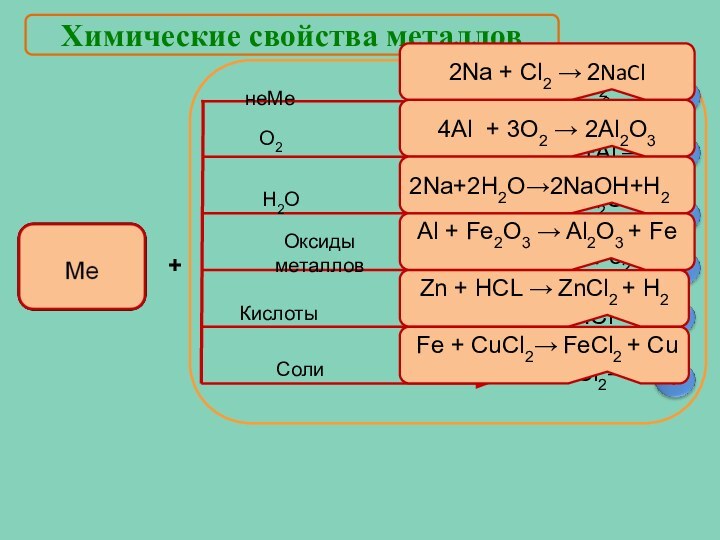
Соли
О2
Zn+HCl →
Fe+CuCl2→
Zn + HCL → ZnCl2 + H2
Fe + CuCl2→ FeCl2 + Cu
Этим способом в промышленности получают металлы, стоящие в ряду напряжений металлов до Al.
Коррозия металлов
Самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды, называется коррозией.